|
GÜNCEL:
07/06/2011 |
|
Sağlık Bakanlığından: TIBBİ CİHAZ YÖNETMELİĞİ BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak ve Tanımlar Amaç ve kapsam MADDE 1 (1) Bu Yönetmeliğin
amacı; tıbbi cihaz ve aksesuarlarının taşıması gereken temel gerekleri
belirlemek ve bu cihazlar ile aksesuarlarının kullanımı sırasında hastaların,
uygulayıcıların, kullanıcıların ve üçüncü şahısların sağlık ve güvenliği
açısından ortaya çıkabilecek tehlikelere karşı korunmalarını sağlamak
amacıyla tasarımına, sınıflandırılmasına, üretimine, piyasaya arzına, hizmete
sunulmasına ve denetlenmesine ilişkin usul ve esasları düzenlemektir. (2) Bu Yönetmelik; kamu kurum
ve kuruluşları ile gerçek ve tüzel kişilerin, tıbbi cihaz ve aksesuarlarının
tasarımı, imalatı, piyasaya arzı, hizmete sunulması, kullanımı ve denetimi
ile ilgili bütün faaliyetlerini kapsar. (3) Bir cihaz 19/1/2005 tarihli
ve 25705 sayılı Resmî Gazetede yayımlanan Beşeri Tıbbi Ürünler
Ruhsatlandırma Yönetmeliği kapsamına giren bir tıbbi ürünün uygulanması
amacıyla üretilmiş ise, anılan cihaz bu Yönetmelik kapsamında
değerlendirilir. Bu durum, tıbbi ürüne Beşeri Tıbbi Ürünler Ruhsatlandırma
Yönetmeliği hükümlerinin uygulanmasını engellemez. (4) Bir cihaz, tıbbi ürün ile
kombine halde tek bir ürün olarak piyasaya sürülüyorsa ve tek kullanımlık
ise, bu tek ürün Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliği hükümlerine
tabidir. Bu durumda, tıbbi cihazın güvenlik ve performansı ile ilgili
hususlar söz konusu olduğunda, bu Yönetmeliğin temel gereklerle ilgili Ek Iinde belirtilen hükümler uygulanır. (5) Cihaz, insan vücudu
üzerindeki işlevine yardımcı olması amacıyla, bir madde ile entegre olarak
kullanılıyorsa ve bu madde cihazdan bağımsız olarak kullanıldığında Beşeri
Tıbbi Ürünler Ruhsatlandırma Yönetmeliği kapsamında tıbbi ürün olarak kabul ediliyorsa,
söz konusu cihaz bu Yönetmelik kapsamında değerlendirilir. (6) Cihaz, insan vücudu
üzerindeki işlevine yardımcı olması amacıyla, bir madde ile entegre olarak
kullanılıyorsa ve bu madde, cihazdan bağımsız olarak kullanıldığında Beşeri
Tıbbi Ürünler Ruhsatlandırma Yönetmeliği kapsamında insan kanı veya
plazmasından elde edilen bir tıbbi ürün (insan kanı türevi) olarak kabul
ediliyor ise, söz konusu cihaz bu Yönetmelik kapsamında değerlendirilir. (7) Bu Yönetmelik; a) İn vitro
tıbbi tanı cihazlarına, b) 9/1/2007 tarihli ve 26398
sayılı Resmî Gazetede yayımlanan Vücuda Yerleştirilebilir Aktif Tıbbi
Cihazlar Yönetmeliği kapsamına giren vücuda yerleştirilebilir aktif tıbbi
cihazlara, c) 19/1/2005 tarihli ve 25705
sayılı Resmî Gazetede yayımlanan Beşeri Tıbbi Ürünler Ruhsatlandırma
Yönetmeliği kapsamına giren tıbbi ürünlere, ç) 24/3/2005 tarihli ve
5324 sayılı Kozmetik Kanunu kapsamına giren kozmetik ürünlere, d) İnsan kanı türevleri hariç
olmak üzere; insan kanı, kan ürünleri, insan kaynaklı plazma veya kan
hücreleri ile insan hücresi, dokusu, nakil organları veya bunlardan imal
edilen ürünlere, e) Cansız hayvan dokuları ve
cansız hayvan dokularından imal edilen ürünleri içeren tıbbi cihazlar hariç
olmak üzere, hayvan kökenli doku ve hücrelere uygulanmaz. (8) Bir ürünün Beşeri Tıbbi
Ürünler Ruhsatlandırma Yönetmeliği veya bu Yönetmelik kapsamında olup olmadığına
karar verilirken ürünün aslî fonksiyonuna bakılır. (9) Bir cihaz imalatçısı
tarafından gerek bu Yönetmeliğe gerekse 29/11/2006 tarihli ve 26361 sayılı
Resmî Gazetede yayımlanan Kişisel Koruyucu Donanım Yönetmeliğine uygun
olarak kullanılması amaçladığında, her iki yönetmelikteki temel sağlık ve
güvenlik gerekleri de yerine getirilir. (10) Bu Yönetmelik kapsamında
uygunluk değerlendirmesine tabi tutulan cihazlar bakımından, 24/10/2007
tarihli ve 26680 sayılı Resmî Gazetede yayımlanan Elektromanyetik Uyumluluk
Yönetmeliği hükümleri aranmaz. (11) Bu Yönetmelik hükümleri,
radyasyon güvenliği ve tıbbi ışınlamalara ilişkin düzenlemelerin uygulanmasını
etkilemez. Dayanak MADDE 2 (1) Bu Yönetmelik; 29/6/2001
tarihli ve 4703 sayılı Ürünlere İlişkin Teknik Mevzuatın Hazırlanması ve
Uygulanmasına Dair Kanuna, 7/5/1987 tarihli ve 3359 sayılı Sağlık Hizmetleri
Temel Kanununun 3 üncü maddesinin birinci fıkrasının (k) bendi ile 9 uncu
maddesinin birinci fıkrasının (c) bendine, 13/12/1983 tarihli ve 181 sayılı
Sağlık Bakanlığının Teşkilat ve Görevleri Hakkında Kanun Hükmünde
Kararnamenin 43 üncü maddesine dayanılarak hazırlanmıştır. Tanımlar MADDE 3 (1) Bu Yönetmelikte yer
alan; a) Aksesuar: Kendi başına tıbbi
cihaz sayılmayan ancak tıbbi cihazın amacına uygun bir şekilde kullanılmasını
temin etmek için bu cihaz ile birlikte kullanılmak üzere imal edilen parçayı
veya parçaları, b) Bakanlık: Sağlık Bakanlığını, c) Cihaz alt kategorisi: Ortak
kullanım amaçlarına ya da ortak teknolojilere sahip tıbbi cihazları, ç) Hizmete sunmak: Bir tıbbi
cihazın, kullanım amacına uygun olarak, piyasada ilk defa kullanılmak üzere
son kullanıcı için hazır hale getirilmesini, d) Ismarlama üretilen cihaz:
Toplu üretime tâbi olan ve tıbbi uygulayıcının isteklerine göre uyarlanan
tıbbi cihazlar hariç olmak üzere; belirli tasarım özelliklerinin yer aldığı
ve belirli bir hastada kullanılmak amacıyla, vasıflı tıbbi uygulayıcı
tarafından düzenlenen reçeteye istinaden imal edilen tıbbi cihazı, e) İmalatçı: Bu Yönetmeliğe
uygun olarak piyasada hazır bulunan tıbbi cihazları hastasına uygun hale
getirip kullanıma hazırlayan kişiler hariç olmak üzere, bizzat kendisi veya
kendisi adına üçüncü bir kişi tarafından yapılmış olmasına bakılmaksızın, bir
tıbbi cihazı kendi adı altında piyasaya arz etmeden önce tasarlayan, imal
eden, paketleyen ve etiketleyen gerçek veya tüzel kişiyi; ayrıca bir veya
birden fazla hazır ürünü bir araya getiren, paketleyen, işleyen, tamamen
yenileyen ve/veya etiketleyen ve/veya bunları kendi adı altında ve kullanım
amacı doğrultusunda tıbbi cihaz olarak piyasaya arz eden gerçek veya tüzel
kişiyi, f) İnsan kanı türevi: İnsan
kanı veya plazmasından türetilen ve tıbbi cihazdan ayrı kullanıldığında,
Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliğinde ifade edilen kan ürünü
bileşeni veya kan ürünü olarak değerlendirilebilen ve tıbbi cihazın insan
vücudu üzerindeki etkisine yardımcı olan maddeleri, g) İn vitro
tıbbi tanı cihazı: İmalatçı tarafından esas olarak; 1) Fizyolojik veya patolojik
durum ile ilgili bilgi edinmek veya 2) Konjenital
anomalilerle ilgili bilgi edinmek ya da 3) Muhtemel alıcılar için
uygunluk ve güvenliği belirlemek veyahut 4) Tedaviyi izlemek amacıyla tek başına veya
birlikte kullanılmasına bakılmaksızın, kan ve doku bağışları da dahil olmak
üzere insan vücudundan alınan numunelerin in vitro
incelenmesi için tasarlanan reaktif, reaktif ürünü, kalibratör,
kontrol materyali, kit, araç, gereç, ekipman veya sistem olan bütün tıbbi
cihazları ve bu numunelerin muhafaza edilmesi amacıyla kullanılan vakumlu
veya vakumsuz numune kaplarını, ğ) Jenerik cihaz grubu: Aynı
veya benzer kullanım amaçlarına veya ortak teknolojiye sahip olan, jenerik
olarak sınıflandırılan ve spesifik özellikler göstermeyen tıbbi cihazları, h) Kanun: 4703 sayılı Ürünlere
İlişkin Teknik Mevzuatın Hazırlanması ve Uygulanmasına Dair Kanunu, ı) Klinik araştırma amaçlı
cihaz: Vasıflı tıbbi uygulayıcı veya klinik araştırma yapmaya yetkili kişi
tarafından yeterli klinik ortamda insan üzerinde, Ek Xun
(2.1) numaralı kısmına uygun olarak yapılacak klinik araştırmaya konu olan
cihaz ya da cihazları, i) Klinik veri: Bir cihazın
kullanımı sonucunda; 1) Söz konusu cihaza ilişkin
klinik araştırmalardan veya 2) Bu cihaza denkliği
gösterilebilen benzer bir cihaza ilişkin bilimsel literatürde yer alan klinik
araştırmalardan veya diğer çalışmalardan ya da 3) Söz konusu cihaz veya bu
cihaza denkliği gösterilebilen benzer bir cihaza ilişkin diğer klinik deneyimler
ile ilgili yayımlanmış ve/veya yayımlanmamış raporlardan elde edilen güvenlik ve/veya
performans bilgilerini, j) Komisyon: Avrupa Birliği
Komisyonunu, k) Kullanım amacı: İmalatçı
tarafından teknik dosyada ayrıntılı olarak ifade edilen ve tıbbi cihazın
kullanım kılavuzunda, tanıtım materyalinde veya etiketinde belirtilen
kullanım maksadını, l) Omuz, diz ve kalça eklem
değişimi cihazları: Vida, çivi, plak gibi yardımcı bileşenler hariç olmak
üzere; doğal bir omuz, diz veya kalça ekleminin işlevini yerine getirmek
amacıyla vücuda yerleştirilebilir eklem değişim sisteminin bileşeni olan
tıbbi cihazı, m) Piyasaya arz: Klinik
araştırma amaçlı cihazlar hariç olmak üzere; yeni veya tamamen yenilenmiş bir
tıbbi cihazın imalat süreci tamamlandıktan sonra ilk defa dağıtım ve/veya
kullanım amacıyla, bedelli veya bedelsiz olarak piyasada yer alması için
yapılan faaliyeti, n) Tek kullanımlık cihaz: Tek
bir hasta için sadece bir kez kullanılacak tıbbi cihazı, o) Tıbbi cihaz: İnsanda
kullanıldıklarında aslî fonksiyonunu farmakolojik, immünolojik veya metabolik etkiler ile sağlamayan fakat fonksiyonunu
yerine getirirken bu etkiler tarafından desteklenebilen ve insan üzerinde; 1) Hastalığın tanısı,
önlenmesi, izlenmesi, tedavisi veya hafifletilmesi ya da 2) Yaralanma veya sakatlığın
tanısı, izlenmesi, tedavisi, hafifletilmesi veya mağduriyetin giderilmesi ya
da 3) Anatomik veya fizyolojik bir
işlevin araştırılması, değiştirilmesi veya yerine başka bir şey konulması
veyahut 4) Doğum kontrolü amacıyla kullanılmak üzere imal
edilmiş, tek başına veya birlikte kullanılabilen, imalatçısı tarafından
özellikle tanı ve/veya tedavi amaçlı kullanılmak üzere imal edilmiş ve tıbbi
cihazın amaçlanan işlevini yerine getirebilmesi için gerekli olan yazılımlar
da dahil, her türlü araç, alet, teçhizat, yazılım, aksesuar veya diğer
malzemeleri, ö) Yetkili temsilci: İmalatçı
tarafından açık olarak yetkilendirilmiş olan ve imalatçı adına bu
Yönetmelikte yer alan yükümlülükleri yerine getirmek üzere hareket eden ve
kurum ve kuruluşlar tarafından muhatap alınabilen Türkiyede yerleşik gerçek
veya tüzel kişiyi, ifade eder. İKİNCİ BÖLÜM Piyasaya Arz ve Hizmete Sunum, Temel Gerekler,
Serbest Dolaşım, Özel Amaçlı Cihazlar, Uyumlaştırılmış
Standartlara Uygunluk ve Korumaya İlişkin Tedbirler Piyasaya arz ve hizmete sunum MADDE 4 (1) Bu Yönetmelik
hükümlerini karşılayan tıbbi cihazların, usulüne uygun olarak tedariki,
kurulumu, muhafazası, bakımı ve amacına uygun olarak kullanımı
gerçekleştirildiğinde piyasaya arzı veya hizmete sunulması sağlanır. Temel gerekler MADDE 5 (1) Tıbbi cihaz ve
aksesuarları, kullanım amacı da dikkate alınmak suretiyle, Ek Ide kendisiyle ilgili belirtilen temel gereklere uygun
olmak zorundadır. (2) Bu Yönetmelik kapsamına
giren cihazların 3/3/2009 tarihli ve 27158 sayılı Resmî Gazetede yayımlanan Makina Emniyeti Yönetmeliği kapsamına da girdiği
durumlarda, söz konusu Yönetmeliğin sağlık ve güvenliğe ilişkin spesifik
temel gereklerinin de karşılanması gerekir. Serbest dolaşım, özel amaçlı
cihazlar MADDE 6 (1) Bu Yönetmeliğin hükümlerine
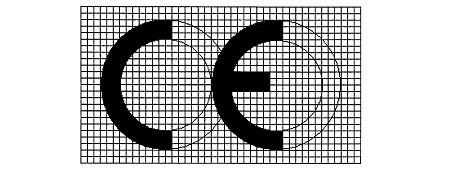
uygun olarak uygunluk değerlendirme işlemlerine tâbi tutulan ve CE işareti
iliştirilen tıbbi cihazların piyasaya arzı veya hizmete sunulması
engellenmez. (2) Aşağıda belirtilen
cihazlara CE işareti iliştirilemez ve bu durumlar için herhangi bir engel
konulmaz: a) 15 inci madde ile Ek VIIIde belirtilen şartlara uygun olan klinik araştırma
amaçlı cihazların, tıbbi uygulayıcı veya klinik araştırma yapmaya yetkili
kişi tarafından kullanılmasına, b) Ek VIIIde
belirtilen beyana sahip olmak koşuluyla bu Yönetmelik hükümlerine uygun
ısmarlama tıbbi cihazlar ile isim veya tanımlayıcı numara ile birlikte
belirli bir hastanın kullanımına sunulan Sınıf IIa,
IIb ve III tıbbi cihazların piyasaya arzına ve
hizmete sunulmalarına. (3) Bu Yönetmelik hükümlerine
uygun olmayan tıbbi cihazların, Yönetmelik hükümleri yerine getirilinceye
kadar piyasaya arz edilemeyeceğini ve hizmete sunulamayacağını açık şekilde
gösteren bir işaret taşımaları kaydıyla, ticarî fuarlar ve sergiler gibi
yerlerde gösterimi engellenemez. (4) Ek Iin
(13) numaralı kısmında belirtilen ve imalatçı tarafından hastalara,
kullanıcılara ve uygulayıcılara yönelik olarak tıbbi cihazla birlikte
verilmesi gereken bilgiler, kullanım kılavuzları, etiketler, bakım-onarım
kitapçığı ve diğer açıklamalar tıbbi cihaz piyasaya arz edildiğinde Türkçe
olmalıdır. Uyumlaştırılmış standartlara
uygunluk MADDE 7 (1) Avrupa Birliği
tarafından yayımlanan uyumlaştırılmış standartlara uygun olarak imal edilen
tıbbi cihazların, 5 inci maddede belirtilen temel gereklerin ilgili
hükümlerini karşıladığı kabul edilir. (2) Uyumlaştırılmış
standartlara uygunluk özellikle; a) Tıbbi ürün içeren tıbbi
cihazlarda, kullanılan malzemeler ile tıbbi ürünler arasındaki etkileşimde, b) Cerrahi ipliklerde, Avrupa Farmakopesi
monograflarını da içerir. (3) Uyumlaştırılmış
standartların temel gerekleri tam olarak karşılamadığının tespit edilmesi
halinde durum Bakanlığa bildirilir. Bakanlık, bu bilgileri Dış Ticaret
Müsteşarlığı aracılığıyla veya elektronik ortamda Komisyona iletir. Korumaya ilişkin tedbirler MADDE 8 (1) Bakanlık, 6 ncı maddenin ikinci fıkrasının (a) bendinde belirtilen
klinik araştırma amaçlı cihazlar hariç olmak üzere; kullanım amacına uygun
olarak kurulan, kullanılan ve devamlılığı sağlanan tıbbi cihazların
kullanımının hasta, kullanıcı, uygulayıcı veya üçüncü kişilerin sağlığı
ve/veya güvenliği açısından tehlike oluşturduğunu tespit ettiğinde, bu
cihazların piyasadan çekilmesini sağlamak, piyasaya arzını engellemek veya
kısıtlamak, hizmete sunulmasını engellemek veya kısıtlamak için gereken bütün
tedbirleri alır. Bununla ilgili gerekçeli kararını ve tıbbi cihazla ilgili
uygunsuzluğun aşağıdaki hususlardan kaynaklanıp kaynaklanmadığına ilişkin
görüşünü Dış Ticaret Müsteşarlığı aracılığıyla veya elektronik ortamda
Komisyona bildirir. a) 5 inci maddedeki temel
gereklerin karşılanmaması, b) 7 nci
maddedeki standartların yanlış uygulanması, c) Standartların kendisinden
kaynaklanan eksiklikler. (2) Bu Yönetmeliğe uygun
olmayan bir tıbbi cihaz CE işareti taşıdığında, Bakanlık, işareti iliştirenlere
karşı gerekli tedbirleri alır ve Dış Ticaret Müsteşarlığı aracılığıyla veya
elektronik ortamda Komisyona bilgi verir. ÜÇÜNCÜ BÖLÜM Sınıflandırma, Uyarı Sistemi, Uygunluk
Değerlendirme İşlemleri, Sistemler, İşlem Paketleri ve Sterilizasyon İçin
Özel Yöntemler ve İstisnaî Durum Bildirimleri Sınıflandırma MADDE 9 (1) Tıbbi cihazlar, Ek IXda belirlenen esaslara göre Sınıf I, IIa, IIb ve III olarak dört
sınıfa ayrılır. (2) Sınıflandırma kurallarının
uygulanmasıyla ilgili olarak, imalatçı ve onaylanmış kuruluş arasında ortaya
çıkabilecek ihtilaflar, taraflarca onaylanmış kuruluşu atayan yetkili
otoriteye iletilir. (3) Bakanlık, tıbbi cihazın
piyasaya arzından sonra 10 uncu madde kapsamında değerlendirilen
olumsuzluklardan elde edilen bilgiler veya teknik gelişmeler ışığında Ek IXda belirtilen sınıflandırma kurallarının yeniden
düzenlenmesini gerekli gördüğünde, gerekçeli talebini Dış Ticaret
Müsteşarlığı aracılığıyla veya elektronik ortamda Komisyona iletir. Uyarı sistemi MADDE 10 (1) Bakanlık, Sınıf I, IIa, IIb veya III tıbbi cihaza
ilişkin bu Yönetmelik hükümleri çerçevesinde kendisine sunulan aşağıdaki
bilgilerin kaydedilmesini, değerlendirilmesini ve gerekli tedbirlerin
alınmasını sağlar. Bu bilgiler şunlardır: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması, 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) Bu fıkranın (a) bendinde
belirlenen nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından
piyasadan sistematik olarak geri çekilmesine yol açan tıbbi cihazın
özelliğine ve performansına bağlı teknik ve tıbbi sebepler. (2) Birinci fıkrada belirtilen
durumlar hakkında ilgili sağlık personeli ve/veya sağlık kuruluşu tarafından
Bakanlığa derhâl bilgi verilir. Bakanlık, gerekli önlemlerin alınmasını
sağlamak üzere, söz konusu olay hakkında imalatçıyı veya yetkili temsilcisini
bilgilendirir. (3) Bakanlık, mümkün olması
halinde imalatçı veya yetkili temsilci ile birlikte gerekli değerlendirmeleri
yaptıktan sonra, 8 inci maddedeki hususlar saklı kalmak kaydıyla, bu maddenin
birinci fıkrasında belirtilen olumsuz olaylar ile bunların yeniden ortaya
çıkma ihtimalini en aza indirmek için alınmış veya alınması öngörülen
tedbirler hakkında Dış Ticaret Müsteşarlığı aracılığıyla veya elektronik
ortamda Komisyonu ivedilikle bilgilendirir. Uygunluk değerlendirme
işlemleri MADDE 11 (1) Uygunluk
değerlendirme işlemlerinde bu maddede belirtilen hususlar dikkate alınır. (2) Ismarlama üretilen cihazlar
ve klinik araştırma amaçlı cihazlar hariç olmak üzere; imalatçı, Sınıf
I tıbbi cihazlara CE işaretini iliştirmek için sadece Ek VIIde
belirlenen işlemi takip eder ve bu ekteki uygunluk beyanını düzenler. (3) Ismarlama üretilen cihazlar
ve klinik araştırma amaçlı cihazlar hariç olmak üzere; imalatçı, Sınıf IIa tıbbi cihazlara CE işaretini iliştirmek için; a) Ek IIde
belirtilen tam kalite güvence sistemiyle [(4) numaralı kısmı hariç olmak
üzere] ilgili uygunluk beyanı işlemini ya da, b) Ek VIIde
belirtilen uygunluk beyanı işlemi ile birlikte; 1) Ek IVte
belirtilen doğrulama ya da, 2) Ek Vte
belirtilen üretim kalite güvencesi veya 3) Ek VIda
belirtilen ürün kalite güvencesiyle ilgili uygunluk beyanı işlemini takip
eder. (4) Ismarlama üretilen cihazlar
ve klinik araştırma cihazları hariç olmak üzere; imalatçı, Sınıf IIb tıbbi cihazlara CE işaretini iliştirmek için; a) Ek IIde
belirtilen tam kalite güvence sistemiyle [(4) numaralı kısmı hariç olmak üzere]
ilgili uygunluk beyanı işlemini ya da, b) Ek IIIde
belirtilen tip incelemesi ile birlikte; 1) Ek IVte
belirtilen doğrulama ya da, 2) Ek Vte
belirtilen üretim kalite güvencesi veya 3) Ek VIda
belirtilen ürün kalite güvencesiyle ilgili uygunluk beyanı işlemini takip
eder. (5) Ismarlama üretilen cihazlar
ve klinik araştırma amaçlı cihazlar hariç olmak üzere; imalatçı, Sınıf III
tıbbi cihazlara CE işaretini iliştirmek için; a) Ek IIde
belirtilen tam kalite güvence sistemiyle ilgili uygunluk beyanı işlemini ya
da, b) Ek IIIde
belirtilen tip incelemesiyle birlikte; 1) Ek IVte
belirtilen doğrulama veya 2) Ek Vte
belirtilen üretim kalite güvencesi ile ilgili uygunluk beyanı işlemini takip
eder. (6) İmalatçı ısmarlama üretilen
cihazlar için, her bir cihazı piyasaya arz etmeden önce Ek VIIIde belirlenen işlemi takip ederek bu Ekteki beyanı
düzenler. Ismarlama üretilen cihazlardan hizmete sunulanların bir listesini
Bakanlığa gönderir. (7) İmalatçı ve/veya onaylanmış
kuruluş, tıbbi cihazın uygunluk değerlendirme işlemleri süresince, bu
Yönetmeliğe uygun olarak üretimin ara aşamasında yapılan değerlendirme ve
doğrulama sonuçlarını göz önünde bulundurur. (8) İmalatçı, Ek III, IV, VII
ve VIIIde belirlenen işlemleri başlatma konusunda
yetkili temsilcisini görevlendirebilir. (9) Uygunluk değerlendirme
işleminde, onaylanmış kuruluşun yer alması gerektiği durumlarda, imalatçı
veya yetkili temsilcisi bu iş için onaylanmış kuruluşlardan birini seçer. (10) Onaylanmış kuruluş,
seçilen işlem çerçevesinde uygunluğu onaylamak için gerekli olan her türlü
bilgi ve belgeleri başvuru sahibinden ister. (11) Onaylanmış kuruluşlarca Ek
II, III, V ve VIya uygun olarak alınan kararlar,
en fazla 5 (beş) yıl süre ile geçerlidir. Ancak, onaylanmış kuruluş ile
imalatçı arasında imzalanan sözleşmede belirlenen süre içinde yapılan
müracaat üzerine, kararın geçerlilik süresi, en fazla 5 (beş) yıllık dönemler
halinde uzatılabilir. (12) İkinci, üçüncü, dördüncü,
beşinci ve altıncı fıkralarda belirtilen yöntemler ile ilgili kayıtlar ve
yazışmalar, Türkçe ve/veya onaylanmış kuruluşun kabul ettiği Avrupa Birliği
resmî dillerinden birinde yapılır. (13) Bakanlık, ikinci, üçüncü,
dördüncü, beşinci ve altıncı fıkralarda belirtilen işlemlerin uygulanmadığı,
fakat kullanıldığında sağlığın korunmasına yardımcı olacağı belirlenen
münferit tıbbi cihazların ülke sınırları içinde piyasaya arzına ve hizmete
sunulmasına gerekçeli bir talep üzerine izin verebilir. Sistemler, işlem paketleri ve
sterilizasyon için özel yöntemler MADDE 12 (1) 11 inci madde hükümleri
çerçevesinde CE işareti iliştirilen tıbbi cihazlar, bir işlem paketi veya
cihaz sistemi halinde piyasaya arz amacıyla bir araya getirildiğinde bu madde
hükümleri uygulanır. Bu işlemi yapan bütün gerçek ve tüzel kişiler; a) İmalatçıların talimatlarına
uygun olarak bir araya getirilen tıbbi cihazları, tıbbi cihazların karşılıklı
uyumunun sağlandığını ve bir araya getirme işleminin bu talimatlara göre
gerçekleştirilmiş olduğunu, b) Bir işlem paketi veya cihaz
sisteminin piyasaya arzında imalatçıların talimatlarına uygun kullanım
kılavuzlarının kullanıcılara sunulduğunu, c) Bu sürecin tamamının iç
kontrol ve muayenelerinin uygun yöntemler ile yapıldığını, belirten bir işlem paketi veya
cihaz sistemi beyanı düzenler. (2) Bu maddenin birinci
fıkrasında belirtilen şartların yerine getirilmemesi durumunda, bir işlem
paketi veya cihaz sisteminin CE işareti taşımayan cihazlarla birleşmesi veya
seçilmiş cihaz kombinasyonunun gerçek kullanım amacıyla uyumlu olmaması
hallerinde, bu cihaz kombinasyonları tek bir tıbbi cihaz olarak işlem görür
ve 11 inci maddenin ilgili hükümleri uygulanır. (3) Sterilizasyon sürecinde; a) Kullanılmadan önce
sterilize edilecek şekilde tasarlanan tıbbi cihazları piyasaya arz etmek amacıyla
sterilize eden gerçek veya tüzel kişiler, Ek II veya Ek Vte
yer alan işlemlerden birini takip eder. b) Sterilitenin
sağlanması ile ilgili işlemlerde, onaylanmış kuruluşun müdahalesi ile Ek II
veya Ek Vin uygulanması, steril paket açılana ya
da zarar görene kadardır. c) Gerçek veya tüzel kişiler,
yapmış oldukları sterilizasyon işlemini imalatçının talimatlarına uygun
olarak gerçekleştirdiklerini belirten bir beyan düzenler. (4) Birinci ve üçüncü
fıkralarda belirtilen tıbbi cihazlar, ilave bir CE işareti taşımazlar. Bu
cihazlar, imalatçıları tarafından verilen ve Ek I/13te belirtilen
bilgileri taşır. Birinci ve üçüncü fıkralarda belirtilen beyanlar, Bakanlığa
sunulmak üzere 5 (beş) yıl süreyle saklanır. Sınıflandırma ve istisnaî
durumlarla ilgili bildirimler MADDE 13 (1) Bakanlık; a) Ek IXda
belirtilen sınıflandırma kurallarının belirli bir tıbbi cihaza veya tıbbi
cihaz grubuna uygulanması sırasında tereddüt hâsıl olup bir karar verilmesi
gerektiğinde; b) Bir tıbbi cihazın veya tıbbi
cihaz grubunun, Ek IX hükümlerine istisna olarak, başka bir sınıf içinde
değerlendirilmesi gerektiğinde; c) Tıbbi cihazın veya tıbbi
cihaz grubunun uygunluğunun, 11 inci madde hükümlerine istisna olarak, söz
konusu maddede belirtilen yöntemlerden sadece birinin uygulanmasıyla
sağlanması gerektiğinde; ç) Belirli bir ürün veya ürün
grubunun, 3 üncü maddenin birinci fıkrasının (a), (d), (g), (ı) veya (o)
bentlerinde yer alan tanımlardan herhangi birine girip girmediğine ilişkin
bir karar almak gerektiğinde; konu ile ilgili talebini,
gerekçeleriyle birlikte gerekli tedbirlerin alınması için Dış Ticaret
Müsteşarlığı aracılığıyla veya elektronik ortamda Komisyona bildirir. DÖRDÜNCÜ BÖLÜM Kayıt Sistemi, Klinik Araştırmalar, Onaylanmış
Kuruluş ve CE İşaretlemesi Kayıt sistemi MADDE 14 (1) Bakanlık, bu maddede
belirtilen esaslara göre piyasaya arz edilmiş olan tıbbi cihazları ve bu cihazların
piyasaya arzından sorumlu kişilerin kayıtlarını tutar. (2) 11 inci maddenin ikinci,
üçüncü, dördüncü, beşinci ve altıncı fıkralarında belirtilen işlemlere uygun
olarak tıbbi cihazı kendi adıyla piyasaya arz eden imalatçı ve 12 nci maddede belirtilen faaliyetlerde bulunan gerçek veya
tüzel kişi, işletme ve tıbbi cihazla ilgili gerekli bilgi ve belgeleri
Bakanlığa bildirir. (3) Bakanlık, Sınıf IIa, IIb ve III tıbbi cihazlar
piyasaya arz edildiğinde, tıbbi cihazların etiketi ve kullanım kılavuzu ile
birlikte söz konusu cihazı tanımlayıcı bilgileri de talep eder. (4) Tıbbi cihazı kendi adıyla
piyasaya arz eden imalatçı ülke sınırları dışında ise, yetkili temsilcisi
Bakanlığa bildirilir. Yetkili temsilci, ülke sınırları içinde kayıtlı şirket
adreslerini ve ikinci fıkrada belirtilen tıbbi cihazlarla ilgili söz konusu
bilgileri Bakanlığa bildirir. (5) Bakanlık, imalatçı veya
yetkili temsilci tarafından üçüncü fıkradaki tıbbi cihazlara ilişkin sunulan
bilgileri, talep olması halinde Dış Ticaret Müsteşarlığı aracılığıyla veya
elektronik ortamda Komisyona bildirir ve gerektiğinde Komisyondan bilgi
ister. (6) Bu Yönetmelik ile ilgili
düzenleyici veriler, yetkili kuruluşların bu Yönetmelik çerçevesindeki görevlerini
yerine getirmelerini temin etmek için tıbbi cihaz veri bankasında saklanır.
Veri bankası, aşağıda belirtilen unsurlardan oluşur: (a) İmalatçıların, yetkili
temsilcilerin ve bu maddenin üçüncü fıkrasında belirtilen tıbbi cihazların
kayıtlarına ilişkin veriler, (b) Ek II, III, IV, V, VI ve VIIde öngörülen yönteme uygun olarak verilen,
değiştirilen, ekleme yapılan, askıya alınan, geri çekilen veya reddedilen
belgeler ile ilgili veriler, (c) 10 uncu maddede düzenlenen
uyarı sistemiyle elde edilen veriler, (ç) 15 inci maddede düzenlenen
klinik araştırmalara ilişkin veriler. (7) Bakanlık, sağlık ve
güvenliğin korunması ve/veya halk sağlığı gereklerinin gözetilmesi amacıyla,
belirli bir tıbbi cihaz veya tıbbi cihaz grubunun piyasadan çekilmesi ya da piyasaya
arzı ve hizmete sunulmasının yasaklanması, sınırlandırılması veya belirli
şartlara tabi tutulması gerektiğinde gerekli bütün önlemleri alır. Bu
durumda, gerekçeli kararını Dış Ticaret Müsteşarlığı aracılığıyla veya
elektronik ortamda Komisyona bildirir. Klinik araştırmalar MADDE 15 (1) İmalatçı veya yetkili
temsilci, klinik araştırma amaçlı cihazlar için Ek VIIIde
belirtilen işlemleri gerçekleştirir ve yapılacak klinik araştırma hakkındaki
gerekli bilgiyi Ek VIIIin (2.2) numaralı kısmında
yer alan beyan ile birlikte Bakanlığa verir. (2) İmalatçı, Sınıf III tıbbi
cihazlar ile Sınıf IIa veya IIbye
dâhil olan implant ve uzun süreli invaziv cihazlar hakkında, ilgili Etik Kurulun onayı ile
birlikte klinik araştırma talebini Bakanlığa bildirir. Bakanlık bildirim
tarihinden 60 (altmış) gün sonra klinik araştırma talebini sonuçlandırır. (3) İlgili Etik Kurulun
araştırma planına kendi gerekçesini eklemek suretiyle olumlu görüş vermesi
halinde, Bakanlık 60 (altmış) günlük sürenin dolmasını beklemeden imalatçıya
söz konusu klinik araştırmanın başlatılması için izin verebilir. (4) İkinci fıkrada belirtilen
cihazlar dışındaki tıbbi cihazlar söz konusu olduğunda, ilgili Etik Kurulun
araştırma planına kendi gerekçesini eklemek suretiyle olumlu görüş vermesi halinde,
Bakanlık imalatçılara hemen klinik araştırma başlatmaları için izin
verebilir. (5) Klinik araştırmalar, Ek Xda belirtilen hükümlere göre yürütülür. (6) Bakanlık gerektiğinde,
klinik araştırmalar bakımından halk sağlığını ve kamu yararını korumaya yönelik
gerekli ve uygun tedbirleri alır. Bakanlık bir klinik araştırmayı
reddettiğinde, durdurduğunda, geçici olarak askıya aldığında veya önemli bir
değişiklik talep ettiğinde söz konusu kararı gerekçesi ile birlikte Dış
Ticaret Müsteşarlığı aracılığıyla veya elektronik ortamda Komisyona bildirir. (7) İmalatçı veya yetkili
temsilci, klinik araştırmanın sonucu ile ilgili olarak Bakanlığa bilgi verir.
Klinik araştırmanın erken sonlandırılması halinde, gerekçesi de ayrıca
bildirilir. Erken sonlandırmanın güvenlik gerekçesi ile yapıldığı durumlarda,
Bakanlık söz konusu durumu Dış Ticaret Müsteşarlığı aracılığıyla veya
elektronik ortamda Komisyona bildirir. Ek X/2.3.7de belirtilen rapor,
Bakanlığa verilmek üzere imalatçı veya yetkili temsilci tarafından hazır bulundurulur. (8) Klinik araştırma, CE
işareti taşıyan tıbbi cihazlar kullanılarak tıbbi cihazın uygunluk değerlendirme
işlemlerinde belirtilen amaç için yapılıyorsa, bunun için sadece Ek Xun ilgili hükümleri uygulanır. Onaylanmış kuruluş MADDE 16 (1) 11 inci maddede
belirtilen görevleri ve kendilerine verilmiş özel görevleri yerine
getirebilecek kuruluşlar Bakanlığa müracaat eder. Bakanlık, onaylanmış
kuruluş adaylarını bu maddede belirtilen hususlar doğrultusunda
değerlendirerek uygun bulunanları Komisyona bildirilmek üzere Dış Ticaret
Müsteşarlığına iletir. Komisyon tarafından kimlik numarası verilmesinin
ardından Bakanlığın onaylanmış kuruluş görevlendirmesine dair kararı Resmî
Gazetede yayımlanır ve onaylanmış kuruluş faaliyete başlar. (2) Onaylanmış kuruluşların
belirlenmesinde, Ek XIde belirtilen şartlara
uygunluk aranır. Bununla birlikte Kanun ve 17/1/2002 tarihli ve 24643 sayılı
Resmî Gazetede yayımlanan Uygunluk Değerlendirme Kuruluşları ile Onaylanmış
Kuruluşlara Dair Yönetmelik hükümleri de uygulanır. Ayrıca, onaylanmış kuruluşlara
ilişkin uyumlaştırılmış standartları karşılayan kuruluşların Ek XIdeki şartları karşıladığı kabul edilir. (3) Talep halinde onaylanmış
kuruluş, bütçe belgeleri de dâhil olmak üzere, Ek XIde
öngörülen şartlara uygunluğun denetlenmesini sağlayacak bütün bilgi ve
belgeleri Bakanlığa verir. (4) Bakanlık, onaylanmış
kuruluşun ikinci fıkrada belirtilen şartlara uymadığını tespit ettiği
takdirde; onaylamayı geçersiz kılar ve bu kararını Resmî Gazetede yayımlar.
Ayrıca Komisyona bildirilmek üzere Dış Ticaret Müsteşarlığına iletir. (5) Onaylanmış kuruluş ile
imalatçı veya yetkili temsilci, Ek II, III, IV, V ve VIda
yer alan değerlendirme ve doğrulama işlemlerinin tamamlanması için gereken
süreyi ortaklaşa belirler. (6) Onaylanmış kuruluş
düzenlediği, değişiklik yaptığı, ekleme yaptığı, askıya aldığı, iptal ettiği
veya geri çektiği tüm belgeler hakkında Bakanlığa bilgi verir. Ayrıca bu
hususlarda ve talep edilmesi halinde, düzenlediği belgeler hakkında, bu
Yönetmelik kapsamında faaliyet gösteren diğer onaylanmış kuruluşlara bilgi
verir. Onaylanmış kuruluş, ayrıca kendisinden talep edilen tüm ilave
bilgileri sağlar. (7) Onaylanmış kuruluş, bu
Yönetmeliğin ilgili hükümlerine imalatçı tarafından uyulmadığını veya
belgenin sehven verilmiş olduğunu tespit ettiğinde; imalatçı tarafından
düzeltici tedbirler alınıncaya ve ilgili gereklere uygunluk temin edilinceye
kadar, verilen belgeyi, orantılılık ilkesini göz önünde bulundurarak askıya
alır, iptal eder veya sınırlamalara tâbi tutar. Bu durumlarda veya Bakanlığın
müdahalesinin gerekli görüldüğü hallerde, onaylanmış kuruluş Bakanlığa bilgi
verir. Bakanlık, bu hususu Dış Ticaret Müsteşarlığı aracılığıyla veya
elektronik ortamda Komisyona bildirir. CE işaretlemesi MADDE 17 (1) CE işaretinin
iliştirilmesinde, aşağıdaki hususlar dikkate alınır: a) Ismarlama üretilen cihazlar
ve klinik araştırma amaçlı cihazlar dışında kalan bütün tıbbi cihazlar,
piyasaya arz edilecekleri zaman, CE işareti ile birlikte Ek II, IV, V ve VIda belirtilen işlemlerin uygulanmasından sorumlu
onaylanmış kuruluşun kimlik numarasını taşımak zorundadır. b) Ek XIIde
belirtilen CE işareti, kolayca görülebilir, okunabilir ve silinmeyecek bir
şekilde tıbbi cihaza, sterilliğini koruyan ambalajına, kullanım kılavuzuna ve
satış ambalajı üzerine iliştirilir. c) CE işaretinin anlamı veya
şekli konusunda yanlış anlamaya yol açabilecek işaret veya ibare iliştirmek
yasaktır. Başka bir işaret, ancak CE işaretinin görülmesini ve okunmasını
engellemeyecek biçimde tıbbi cihazın üzerine, ambalajının üzerine veya
kullanım kılavuzuna konulabilir. (2) Ayrıca, CE işaretinin
iliştirilmesi ve kullanılması konusunda, Kanun ile 17/1/2002 tarihli ve 24643
sayılı Resmî Gazetede yayımlanan "CE" Uygunluk İşaretinin Ürüne
İliştirilmesine ve Kullanılmasına Dair Yönetmelik hükümlerine de uyulması
zorunludur. Usulsüz olarak iliştirilmiş CE
işareti MADDE 18 (1) CE işaretinin usulsüz
olarak tıbbi cihaza iliştirilmiş olduğunun veya hiç iliştirilmediğinin tespit
edilmesi halinde 8 inci madde hükümleri saklı kalmak kaydıyla; imalatçı veya
yetkili temsilcisi, Bakanlıkça belirlenen şartlar çerçevesinde ihlâle son
vermek zorundadır. İhlâlin devamı halinde Bakanlık, tıbbi cihazın piyasaya
arzını kısıtlayıcı veya yasaklayıcı gerekli bütün tedbirleri alarak, tıbbi
cihazın piyasadan çekilmesini sağlar. (2) Bu Yönetmelik kapsamında
olmadığı halde, bu Yönetmelik hükümlerine göre CE işareti iliştirilen
ürünlere de birinci fıkra hükümleri uygulanır. BEŞİNCİ BÖLÜM Çeşitli Hükümler Ret veya sınırlama kararları MADDE 19 (1) Bakanlıkça bu
Yönetmeliğin uygulanması sırasında, a) Tıbbi cihazın piyasaya
arzına, hizmete sunulmasına veya klinik araştırmalara yönelik ret veya
sınırlayıcı nitelikte alınan kararlar, b) Tıbbi cihazların piyasadan
çekilmesine ilişkin olarak alınan kararlar, gerekçeleri ile birlikte açıkça
belirtilir. (2) Birinci fıkrada belirtilen
bütün kararlar için, alınacak tedbirin aciliyet
durumuna göre mümkün olması halinde imalatçı veya yetkili temsilci görüşünü
önceden belirtme hakkına sahiptir. (3) Tıbbi cihaz(lar)a ilişkin ret veya sınırlama ya da piyasadan çekme iş
ve işlemleri ile ilgili olarak ayrıca, Kanun ile 25/6/2007 tarihli ve 26563
sayılı Resmî Gazetede yayımlanan Sağlık Bakanlığınca Yapılacak Piyasa
Gözetimi ve Denetiminin Usul ve Esasları Hakkında Yönetmelik hükümleri de
uygulanır. Gizlilik MADDE 20 (1) Bakanlık, onaylanmış
kuruluş ve bu Yönetmeliğin uygulanmasına katılan bütün taraflar, görevlerini
yerine getirirken temin ettikleri bütün bilgilerin gizliliğini sağlar. Ancak,
Bakanlığın diğer ülke yetkili kuruluşları ve onaylanmış kuruluşlar ile
karşılıklı bilgi paylaşımı ve uyarı sistemi kapsamındaki yükümlülükleri
saklıdır. Ayrıca gizlilik mahiyetine haiz bu bilgiler, kamu sağlığının ve
düzeninin gerektirdiği hallerde, adlî ve ilgili üst mercilerin talebi
üzerine, Bakanlığa bilgi verilmek suretiyle açıklanabilir. (2) Aşağıdaki hususlar gizlilik
kapsamında değerlendirilmez: a) 14 üncü maddeye göre tıbbi
cihazların piyasaya arzından sorumlu kişilerin kayıt bilgileri, b) 10 uncu maddenin üçüncü
fıkrasında belirtilen önlemlere uygun olarak imalatçı, yetkili temsilci veya
dağıtıcı tarafından kullanıcılara gönderilen bilgiler, c) Düzenlenen, düzeltme
yapılan, ekleme yapılan, askıya alınan veya iptal edilen sertifikalarda yer
alan bilgiler. Danışma komisyonları MADDE 21 (1) Bakanlık, tıbbi
cihazlar ve standartlar konusunda, bünyesinde bulunan teknik düzenleme ve danışma
komisyonları yetersiz kaldığında, yeni danışma komisyonları oluşturabilir.
Danışma komisyonlarının oluşturulması, çalışma usûl
ve esasları ile görev, yetki ve sorumlulukları Bakanlıkça çıkarılacak Yönerge
ile belirlenir. Diğer mevzuata uyum MADDE 22 (1) Tıbbi cihaz, CE
işaretinin iliştirilmesini öngören başka mevzuatın da konusuna giriyor ise,
ilgili diğer mevzuat hükümlerine de uygun olmak zorundadır. (2) İlgili diğer mevzuatın bir
veya daha fazlası, bir geçiş dönemi boyunca imalatçıya uygulama konusunda
seçme hakkı tanıyor ise CE işareti sadece, imalatçının uygulamayı seçtiği
mevzuat hükümlerine uygunluğu gösterir. Bu durumda, hangi mevzuatın
uygulandığı, tıbbi cihazla birlikte verilen belgelerde, uyarılarda, etiket
veya kullanım kılavuzunda belirtilir. ALTINCI BÖLÜM Son Hükümler Kullanım güvenliği MADDE 23 (1) Tıbbi cihazlar
imalatçının öngördüğü kullanım amacı ve varsa kullanım kılavuzunda belirtilen
öneriler dikkate alınarak kullanılır. (2) Kurulum, kalite
kontrol testleri, kalibrasyon veya bakım-onarım gerektiren tıbbi cihazlarda
söz konusu işlemler imalatçının öngördüğü şekilde gerçekleştirilir. (3) Tıbbi cihazların güvenli
kullanımını sağlamak için imalatçının öngördüğü hususlar dikkate alınarak
gerekli eğitimler yapılır. Aykırı davranışlar hakkında
uygulanacak hükümler MADDE 24 (1) Bu Yönetmelik
hükümlerine aykırı davranan ve faaliyet gösterenler hakkında Kanun, 26/9/2004
tarihli ve 5237 sayılı Türk Ceza Kanunu ve ilgili diğer mevzuat hükümleri
uygulanır. Uyumlaştırılan Avrupa Birliği
mevzuatı MADDE 25 (1) Bu Yönetmelik, Avrupa
Birliğinin tıbbi cihazlar ile ilgili mevzuatına uyum sağlanması amacıyla; a) 93/42/EEC sayılı Tıbbi
Cihazlar Direktifine, b) 98/79/EC sayılı İn Vitro Tıbbi Tanı Cihazları Direktifine, c) 2000/70/EC sayılı İnsan Kanı
veya Plazmasının Stabil Türevlerini İhtiva Eden Tıbbi Cihazlar Direktifine, ç) 93/42/EEC sayılı Tıbbi Cihaz
Direktifinde değişiklik yapılmasına dair 2001/104/EC sayılı Direktifine, d) 93/42/EEC sayılı Tıbbi Cihaz
Direktifi çerçevesinde meme implantlarının yeniden
sınıflandırılmasına dair 2003/12/EC sayılı Komisyon Direktifine, e) 93/42/EEC sayılı Tıbbi Cihaz
Direktifi çerçevesinde omuz, diz ve kalça eklem değişimi cihazlarının yeniden
sınıflandırılmasına dair 2005/50/EC sayılı Komisyon Direktifine, f) 90/385/EEC sayılı Vücuda
Yerleştirilebilir Aktif Tıbbi Cihazlar Direktifinde, 93/42/EEC sayılı Tıbbi
Cihaz Direktifinde ve 98/8/EC sayılı Biyosidal
Ürünlerin Piyasaya Arzına İlişkin Direktifte değişiklik yapılmasına dair
2007/47/EC sayılı Direktifine paralel olarak hazırlanmıştır. Atıflar MADDE 26 (1) Daha önce diğer
düzenlemelerde, 9/1/2007 tarihli ve 26398 sayılı Resmî Gazetede yayımlanan
Tıbbi Cihaz Yönetmeliğine yapılan atıflar, bu Yönetmeliğe yapılmış olarak
kabul edilir. Yürürlükten kaldırılan
yönetmelik MADDE 27 (1) 9/1/2007 tarihli ve
26398 sayılı Resmî Gazetede yayımlanan Tıbbi Cihaz Yönetmeliği yürürlükten
kaldırılmıştır. Yürürlük MADDE 28 (1) Bu Yönetmelik, yayımı
tarihinde yürürlüğe girer. Yürütme MADDE 29 (1) Bu Yönetmelik
hükümlerini Sağlık Bakanı yürütür. EK I TEMEL GEREKLER I. GENEL GEREKLER 1) Tıbbi cihazlar, kullanım
amaçlarına ve şartlarına uygun olarak kullanıldığında hastaların klinik
durumunu veya güvenliğini, kullanıcıların veya gerektiğinde diğer şahısların
sağlığını veya güvenliğini tehlikeye düşürmeyecek şekilde tasarlanmalı ve
üretilmelidir. Tıbbi cihazların kullanım
amaçları ile ilgili riskler, hastaya olan faydaları ile kıyaslandığında kabul
edilebilir olmalı, sağlık ve güvenliğin yüksek düzeyde korunmasını
sağlamalıdır. Tıbbi cihazın tasarımında; - cihazın ergonomik
özelliklerinden ve cihazın kullanılması amaçlanan ortamdan kaynaklanabilecek
hatalı kullanım riskinin mümkün olduğunca azaltılması (hasta güvenliğine
yönelik tasarım) ve - cihazı kullanması düşünülen
kişilerin teknik bilgisi, deneyimi, öğrenim durumu ve mümkünse tıbbi ve
fiziksel durumunun göz önüne alınması (profesyonel, engelli veya diğer
kullanıcılara yönelik tasarım) gerekir. 2) İmalatçının tıbbi cihazların
tasarım ve yapımında benimsediği çözümler, genel olarak kabul görmüş teknik
yöntemleri içermeli ve güvenlik prensiplerine uygun olmalıdır. İmalatçı, en
uygun çözümlerin seçiminde aşağıda belirtilen hususları uygulamalıdır: - Tehlikeleri mümkün olduğu
kadar azaltmak veya ortadan kaldırmak için güvenli tasarım ve üretim
yapmalıdır, - Tehlikelerin ortadan
kaldırılamaması halinde, alarm gibi gerekli ve yeterli koruma önlemleri alınmalıdır, - Alınan koruma tedbirlerinin
tehlikeleri tümüyle ortadan kaldıramadığı durumlarda, geriye kalan riskler
kullanıcıya bildirilmelidir. 3) Tıbbi cihaz, imalatçı
tarafından öngörülen performansa ulaşmalı ve bu Yönetmeliğin 3 üncü
maddesinin birinci fıkrasının (o) bendinde belirtilen işlevlerin biri veya
birden fazlasına uygun olabilecek bir tarzda tasarlanmalı, imal edilmeli ve
ambalajlanmalıdır. 4) Tıbbi cihazın imalatçı
tarafından belirtilen kullanım süresi boyunca, normal şartlar altında kullanımı
sırasında ortaya çıkabilecek olumsuzluklar; tıbbi cihazın bu Ekin (1), (2) ve
(3) numaralı kısımlarında belirtilen özellikleri, performansı ve klinik
şartları değiştirecek, hastanın, kullanıcının ve üçüncü kişilerin sağlık ve
güvenliğini bozacak nitelikte olmamalıdır. 5) Tıbbi cihazlar, imalatçıdan
temin edilen kullanım kılavuzunda verilen bilgilere uygun şekilde nakledildiğinde
ve depolandığında, öngörülen kullanım süresince özellikleri ve performansı
olumsuz yönde etkilenmeyecek şekilde tasarlanmış, imal edilmiş ve paketlenmiş
olmalıdır. 6) Tıbbi cihazın istenmeyen yan
etkilerinin oluşturacağı risk, tıbbi cihazdan beklenen performanslarla
kıyaslandığında, kabul edilebilir olmalıdır. 6.a) Tıbbi cihazın temel
gereklere uygunluğu, Ek Xa göre yapılan bir klinik
değerlendirmeyi içermelidir. II. TASARIM VE YAPIM İLE İLGİLİ
GEREKLER 7) Kimyasal, fiziksel ve
biyolojik özellikler: 7.1. Tıbbi cihazlar, bu Ekin
"Genel Gerekler"inde belirtilen
özellikleri ve performansı garanti edecek şekilde, özellikle aşağıdaki
hususlar göz önünde bulundurularak, tasarlanmalı ve imal edilmelidir. - Kullanılacak malzemenin
seçiminde özellikle toksisite ve alevlenebilirlik
özelliği, - Tıbbi cihazların kullanım
amacı göz önüne alınarak, kullanılan malzeme ile biyolojik doku, hücre ve
vücut sıvıları arasındaki uyum, - Gerektiğinde, geçerliliği
önceden kanıtlanmış biyofiziksel veya modelleme araştırma sonuçları. 7.2. Tıbbi cihazlar; kullanım
amacına uygun olarak, hastalar, tıbbi cihazı kullanan, muhafaza eden ve
naklini yapan kişiler için kalıntı ve kontaminantlar
yönünden tehlikeleri asgariye indirecek şekilde tasarlanmalı, imal edilmeli
ve paketlenmelidir. Tıbbi cihaza maruz kalan dokulara, maruz kalma süresi ve
sıklığına özellikle dikkat edilmelidir. 7.3. Tıbbi cihazlar, normal kullanımları
sırasında veya rutin işlemler uygulanırken temas ettikleri malzemeler, maddeler
ve gazlar ile güvenli şekilde kullanılabilecek tarzda tasarlanmalı ve imal
edilmelidir. Tıbbi cihazın tıbbi ürün vermesi amaçlanıyorsa, bu cihazlar
ilgili ürünlere ait önlem ve kısıtlamalara göre tasarlanmış ve imal edilmiş
olmalı ve her ikisinin de performansları kullanım amacına uygun olarak sürdürülmelidir. 7.4. Tek başına kullanıldığında
Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliğinde yer alan tıbbi ürün kapsamında
değerlendirilen bir madde, tıbbi cihazın insan vücudu üzerindeki fonksiyonunu
destekleyen tamamlayıcı bir parçası olarak kullanıldığında, bu maddenin
güvenli, kaliteli ve yararlı olup olmadığı, söz konusu Yönetmelikte
tanımlanan uygun metotlar ile kıyaslanmak suretiyle değerlendirilmelidir. Birinci paragrafta belirtilen
maddelerle ilgili olarak; onaylanmış kuruluş, bu maddenin tıbbi cihazın bir
parçası olarak kullanılmasının faydalı olup olmadığını değerlendirmek ve
cihazın kullanım amacını dikkate almak suretiyle, söz konusu maddenin
kaliteli ve güvenli olup olmadığına ve cihazda kullanılmasının ortaya
çıkaracağı klinik fayda/risk profiline ilişkin olarak Bakanlığın veya Avrupa
Tıbbi Ürünler Değerlendirme Ajansının (EMEA) ilgili mevzuata uygun olarak
vereceği bilimsel görüşe başvurur. Söz konusu bilimsel görüşte, imalat süreci
ve bu maddenin tıbbi cihaza eklenmesinin sağlayacağı faydaya ilişkin onaylanmış
kuruluş tarafından hazırlanan veriler dikkate alınır. Bir tıbbi cihaz, bütünün bir
parçası olarak insan kanı türevi ihtiva ediyorsa, onaylanmış kuruluş, bu
maddenin tıbbi cihazın parçası olarak kullanılmasının yararlı olup olmadığını
değerlendirmek ve cihazın kullanım amacını dikkate almak suretiyle, bu
türevin kaliteli ve güvenli olup olmadığına ve cihazda kullanılmasının ortaya
çıkaracağı klinik fayda/risk profiline ilişkin olarak Avrupa Tıbbi Ürünler
Değerlendirme Ajansından (EMEA) bilimsel görüş ister. Söz konusu
bilimsel görüşte, imalat sürecini ve bu maddenin tıbbi cihazda
kullanılmasının sağlayacağı faydaya ilişkin onaylanmış kuruluş tarafından
hazırlanan veriler dikkate alınır. Tıbbi cihazda yer alan ve
özellikle de imalat sürecine ilişkin tamamlayıcı maddeler üzerinde değişiklik
yapıldığında, bu değişiklikler onaylanmış kuruluşa bildirilir. Onaylanmış
kuruluş bu maddelerin kaliteli ve güvenli olma durumlarının korunduğunu teyit
amacıyla, daha önce görüş aldığı Bakanlığa veya Avrupa Tıbbi Ürünler
Değerlendirme Ajansına (EMEA) tekrar başvurur. Görüş veren kurum, yapılan
değişikliklerin tıbbi cihazdaki madde için daha önce hazırlanan fayda/risk
profilini olumsuz etkilemediğini teyit etmek üzere, söz konusu maddenin tıbbi
cihaza eklenmesinin sağlayacağı faydaya ilişkin onaylanmış kuruluş tarafından
hazırlanan verileri dikkate alır. Görüşü veren kurum, söz konusu
tamamlayıcı maddenin tıbbi cihazda kullanılması halinde mevcut fayda/risk profilini
etkileyebileceğine dair bilgiye ulaştığında, böyle bir etkinin olup olmadığı
konusundaki görüşünü onaylanmış kuruluşa bildirir. Onaylanmış kuruluş,
uygunluk değerlendirme sürecinin değerlendirilmesinde güncel bilimsel görüşü
dikkate alır. 7.5. Tıbbi cihazlar,
kendisinden sızan maddelerin meydana getirebileceği tehlikeleri asgariye
indirebilecek şekilde tasarlanmalı ve imal edilmelidir. 26/12/2008 tarihli ve
27092 Mükerrer sayılı Resmî Gazetede yayımlanan Tehlikeli Maddelerin ve
Müstahzarların Sınıflandırılması, Ambalajlanması ve Etiketlenmesi Hakkında
Yönetmeliğe göre kanserojen, mutajen veya üreme
üzerine toksik etki gösteren maddelere özel önem
verilir. İlaçları, vücut sıvılarını veya
diğer maddeleri vücuda uygulamayı ve/veya vücuttan uzaklaştırmayı amaçlayan
bir tıbbi cihazın veya tıbbi cihazın bir parçasının ya da bu tür vücut
sıvılarını veya maddeleri taşıma ve depolama amaçlı tıbbi cihazların
Tehlikeli Maddelerin ve Müstahzarların Sınıflandırılması, Ambalajlanması ve
Etiketlenmesi Hakkında Yönetmeliğe göre kanserojen, mutajen
veya üreme üzerine toksik etki gösteren kategori 1
ve 2 grubu ftalatlar içermesi durumunda, tıbbi
cihaz üzerinde ve/veya her bir parçanın paketi üzerinde veya gerektiğinde
satış paketi üzerinde tıbbi cihazın ftalat
içerdiğini gösterir etiketleme yapılmalıdır. Söz konusu tıbbi cihazların
gebe, emziren kadınlar veya çocukların tedavisinde kullanılması
amaçlandığında, imalatçı, bilhassa bu bentle ilgili temel gereklere uygunluk
bakımından bu tür maddelerin kullanımının özel gerekçesine ve söz konusu
hasta gruplarına yönelik riskler ile gerektiğinde uygun ihtiyati tedbirlere
ilişkin bilgilere teknik dosya ve kullanım kılavuzunda yer vermelidir. 7.6. Tıbbi cihaz, kendisi ve
kullanılacağı çevre şartları göz önüne alınarak içine istenmeden giren
maddelere bağlı tehlikeleri asgariye indirecek tarzda tasarlanmalı ve imal
edilmelidir. 8) Enfeksiyon ve mikrobiyolojik
kontaminasyon: 8.1. Tıbbi cihazlar ve imalat
işlemleri; hastanın, uygulayıcının ve üçüncü kişilerin enfeksiyon tehlikesini
ortadan kaldıracak veya mümkün olduğunca azaltacak şekilde tasarlanmalıdır.
Tasarım kolayca uygulanabilmeli ve gerektiğinde kullanım sırasında hastanın
tıbbi cihazdan veya tıbbi cihazın hastadan kontaminasyonunu
asgariye indirmelidir. 8.2. Hayvan kökenli dokular,
kullanım amacına uygun denetimden ve veteriner kontrolünden geçmiş
hayvanlardan sağlanmalıdır. Onaylanmış kuruluşlar,
hayvanların coğrafi kökenine ait bilgileri saklamalıdır. Hayvan kökenli hücrelerin ve
maddelerin işlenmesi, korunması, test edilmesi ve kullanımı en uygun güvenlik
şartlarında yapılmalıdır. Özellikle virüsler ve diğer bulaşıcı ajanlar ile
ilgili güvenlik, imalat sürecinde geçerli eliminasyon veya viral inaktivasyon metotları
uygulanarak sağlanmalıdır. 8.3. Steril tıbbi cihazlar, tek
kullanımlık ambalajlarda piyasaya arz edildiğinde, depolama ve nakil
aşamalarında, koruyucu ambalajı açılıncaya veya bozuluncaya kadar steril
kalmasını sağlayacak uygun yöntemlere göre tasarlanmalı, imal edilmeli ve
paketlenmelidir. 8.4. Steril tıbbi cihazlar
uygun ve geçerli bir metotla imal edilmiş ve steril edilmiş olmalıdır. 8.5. Sterilizasyonu gereken
tıbbi cihazlar, usulüne uygun olarak kontrollü ortamlarda (örneğin, çevre
şartları) imal edilmelidir. 8.6. Steril olmayan tıbbi
cihazların ambalajlama sistemleri; tıbbi cihazın bozulma olmaksızın,
öngörülen temizlik düzeyini koruyacak şekilde ve şayet tıbbi cihazlar
kullanımdan önce steril edilecek ise, mikrobiyolojik kontaminasyon
tehlikesini asgariye indirecek şekilde olmalıdır. Ambalajlama sistemi imalatçı
tarafından belirtilen sterilizasyon metodu ile sterilizasyona uygun
olmalıdır. 8.7. Tıbbi cihazın ambalajı
ve/veya etiketi, steril olmadan ve steril olarak satılan aynı veya benzer
tıbbi cihazları ayırt edecek şekilde olmalıdır. 9) Yapım ve çevresel
özellikler: 9.1. Tıbbi cihaz, bir başka
tıbbi cihaz veya ekipmanla kombine halde kullanılacaksa, bağlantı sistemleri
dahil tüm kombinasyon güvenli olmalı ve söz konusu cihazın belirlenmiş
performansını azaltmamalıdır. Kullanıma yönelik kısıtlamalar etiket veya
kullanım kılavuzunda belirtilmelidir. 9.2. Tıbbi cihaz, aşağıda
belirtilen tehlikeleri ortadan kaldıracak veya mümkün olmadığı hallerde
asgariye indirecek tarzda tasarlanmalı ve imal edilmelidir. - Boyutsal ve ergonomik
özellikler ile hacim/basınç oranı dâhil tıbbi cihazın fiziksel özelliklerine
bağlı yaralanma tehlikesi. - Manyetik alan, harici
elektriksel etkiler, elektrostatik deşarj, basınç, ısı veya ivme ve basınç
değişiklikleri gibi tahmini çevre koşullarına bağlı tehlikeler. - Uygulanan tedavi veya klinik
araştırmalar sırasında normal olarak kullanılan diğer tıbbi cihazlarla
karşılıklı etkileşim tehlikeleri. - Herhangi bir ölçüm veya
kontrol mekanizmasının geçerliliğini yitirmesi veya kullanılan malzemenin
yaşlanması, yıpranması sonucu bakım veya kalibrasyonun mümkün olmadığı
durumlarda (implantlarda olduğu gibi) ortaya çıkan
tehlikeler. 9.3. Tıbbi cihaz, normal
kullanımı sırasında ve basit bir hatada dahi yanma veya patlama tehlikesini
asgariye indirecek şekilde tasarlanmalı ve imal edilmelidir. Özellikle, tıbbi
cihazın parlayıcı, patlayıcı veya yanıcı maddelerle birlikte kullanımı
gerektiğinde, bu hususlara dikkat edilmelidir. 10) Ölçüm fonksiyonlu tıbbi cihazlar: 10.1. Ölçüm fonksiyonlu tıbbi
cihazlar, tıbbi cihazın öngörülen amacı dikkate alınarak, yeterli hassasiyeti
sağlayacak ve uygun ölçüm hassasiyet limitleri içinde kalacak şekilde
tasarlanmalı ve imal edilmelidir. Hassasiyet limitleri imalatçı tarafından
belirlenmelidir. 10.2. Ölçme, izleme ve gösterge
skalası tıbbi cihazın kullanım amacı dikkate alınarak ergonomik prensiplere
göre tasarlanmalıdır. 10.3. Ölçüm fonksiyonlu tıbbi
cihazla gerçekleştirilen ölçümler, 21/6/2002 tarihli ve 24792 sayılı Resmî
Gazetede yayımlanan Uluslararası Birimler Sistemine Dair Yönetmelikte
belirtilen ölçü birimleri ile ifade edilmelidir. 11) Radyasyona karşı koruma: 11.1. Genel olarak: 11.1.1. Tıbbi cihazların
tasarımında ve imalatında; radyasyona maruz kalan hastalar, kullanıcılar ve
üçüncü kişiler üzerinde oluşabilecek etkiyi asgariye indirecek şekilde
gerekli tedbirler alınmalıdır. Bununla birlikte tıbbi cihaz, tedavi ve teşhis
için belirtilen uygun dozların uygulanmasını kısıtlamayacak şekilde tasarlanmalı
ve imal edilmelidir. 11.2. İstenen radyasyon: 11.2.1. Emisyonun sağladığı
faydanın emisyon kaynaklı risklerden daha baskın olduğu özel bir tıbbi amaç
için tehlikeli düzeyde radyasyon yayan bir tıbbi cihazın tasarımı söz konusu
olduğunda, kullanıcıya emisyonu kontrol etme imkanı tanınmalıdır. Bu tıbbi
cihazlar, ilgili daimi değişken parametrelerin tolerans ve yeniden
üretilebilirliğini sağlayacak şekilde tasarlanmalı ve imal edilmelidir. 11.2.2. Tıbbi cihaz görülebilir
ve/veya görülemeyen potansiyel radyasyon tehlikesi oluşturduğunda, görsel
ve/veya sesli ikaz sistemleriyle donatılmış olmalıdır. 11.3. İstenmeyen radyasyon: 11.3.1. Tıbbi cihaz,
hastaların, kullanıcıların ve üçüncü kişilerin, istenmeyen, hedefinden sapan
veya serpinti halindeki radyasyon emisyonuna maruz kalmasını mümkün olduğunca
asgariye indirecek şekilde tasarlanmalı ve imal edilmelidir. 11.4. Kullanım kılavuzları: 11.4.1. Radyasyon yayan tıbbi
cihazların kullanım kılavuzları, yayılan radyasyonun niteliği, hasta ve
kullanıcının korunmasına yönelik önlemler ve hatalı kullanımdan sakınma
yolları ile tıbbi cihazın kurulumundan kaynaklanan tehlikelerin ortadan
kaldırılması hakkında ayrıntılı bilgi içermelidir. 11.5. İyonlaştırıcı radyasyon: 11.5.1. İyonlaştırıcı radyasyon
yayan tıbbi cihazlar, mümkün olduğu kadar, yayılan radyasyonun nitelik,
nicelik ve geometrisinin kullanım amacına göre düzenlenebilmesini ve kontrol
edilebilmesini sağlayacak şekilde tasarlanmalı ve imal edilmelidir. 11.5.2. Radyodiagnostik
amaçlı iyonlaştırıcı radyasyon yayan tıbbi cihazlar, hastanın ve kullanıcının
radyasyona maruz kalmasını asgariye indirerek, öngörülen tıbbi amaca uygun
görüntü ve/veya çıktının kalitesini sağlayacak şekilde tasarlanmalı ve imal
edilmelidir. 11.5.3. Radyoterapi amaçlı
iyonlaştırıcı radyasyon yayan tıbbi cihazlar, uygulanan dozun, ışın tipinin
ve enerjisinin, gerektiğinde ışın kalitesinin güvenilir bir gözlem ve
kontrolüne olanak sağlayacak şekilde tasarlanmalı ve imal edilmelidir. 12) Bir enerji kaynağıyla
donatılmış veya bağlantılı tıbbi cihazlar için gerekler: 12.1. Programlanabilen
elektronik sistemler içeren tıbbi cihazlar, öngörülen kullanıma uygun olarak
bu sistemlerin sürekliliğini, güvenilirliğini ve performansını sağlayacak
şekilde tasarlanmalıdır. Tıbbi cihaz, sistemde herhangi bir hata oluştuğunda,
muhtemel tehlikeleri asgariye indirecek veya ortadan kaldıracak uygun
araçlarla donatılmalıdır. 12.1.a. Yazılım içeren veya
kendisi bir tıbbi yazılım olan tıbbi cihazların yazılımları, gelişim evreleri,
risk yönetimi, geçerli kılma ve doğrulama ilkeleri dikkate alınarak, güncel
teknolojiye uygun olmalıdır. 12.2. Hasta güvenliğinin dâhili
enerji kaynağına bağlı olduğu durumlarda tıbbi cihaz, güç kaynağının durumunu
gösteren bir gereçle donatılmalıdır. 12.3. Hasta güvenliğinin harici
enerji kaynağına bağlı olduğu durumlarda tıbbi cihaz, enerji kaynağının
kesilmesi durumunda sinyal veren bir alarm sistemiyle donatılmalıdır. 12.4. Hastanın bir veya birden
fazla sayıda klinik parametrelerini izleme amaçlı tıbbi cihazlar, hastanın
ölümüne veya sağlık durumunda ciddi bozulmaya yol açabilen durumlarda,
kullanıcıyı uyaran uygun alarm sistemleriyle donatılmalıdır. 12.5. Tıbbi cihazlar, aynı
çevrede bulunan diğer tıbbi cihaz veya ekipmanların çalışmasını
etkileyebilecek elektromanyetik alan yaratma riskini asgariye indirilebilecek
şekilde tasarlanmalı ve imal edilmelidir. 12.6. Elektriksel tehlikelere
karşı koruma: Doğru şekilde kurulumu
sağlanmış tıbbi cihazlar, normal kullanımı sırasında ve basit bir hata olması
durumunda dahi elektriksel şok riski oluşturmayacak şekilde tasarlanmalı ve
imal edilmelidir. 12.7. Mekanik ve ısısal
tehlikelere karşı koruma: 12.7.1. Tıbbi cihazlar,
dayanıklılık, stabilite, hareketli parçalar ve
benzerlerinden kaynaklanan mekanik tehlikelerden kullanıcı ve hastayı
koruyacak şekilde tasarlanmalı ve imal edilmelidir. 12.7.2. Tıbbi cihazlar,
titreşimleri belirlenmiş performansın bir parçası olmadıkça, özellikle
kaynakta titreşimleri sınırlayıcı araçlar ve teknik gelişmeler dikkate
alınarak, tıbbi cihazın titreşimlerinden kaynaklanan tehlikeleri asgariye
indirecek şekilde tasarlanmalı ve imal edilmelidir. 12.7.3. Tıbbi cihazlar,
çıkardıkları sesler belirlenmiş performansın bir parçası değilse, özellikle
kaynakta çıkardığı sesi sınırlayıcı araçlar ve teknik gelişmeler göz önüne
alınarak, tıbbi cihazın çıkardığı sesten kaynaklanan tehlikeleri asgariye
indirecek şekilde tasarlanmalı ve imal edilmelidir. 12.7.4. Kullanıcı tarafından
elle kullanılması gereken terminaller ile elektrik, gaz, hidrolik ve pnömatik enerji kaynaklarına bağlantılar, muhtemel
riskleri asgariye indirecek şekilde tasarlanmalı ve imal edilmelidir. 12.7.5. Isı sağlama veya
belirli ısılara erişme amaçlı parçalar ve alanlar hariç olmak üzere, tıbbi
cihazların el değen kısımları ve bunların çevreleri normal kullanım
şartlarında tehlike yaratacak ısı seviyesine ulaşmamalıdır. 12.8. Maddelerin verilmesinde
veya enerji temininde hasta için oluşabilecek tehlikelere karşı koruma: 12.8.1. Hastaya maddelerin
verilmesine veya enerji teminine yönelik tıbbi cihazlar, kullanıcının ve
hastanın güvenliğini garanti etmek için uygun akış hızının sağlanacağı ve
yeterli hassasiyette sürdürülebileceği şekilde tasarlanmalı ve imal
edilmelidir. 12.8.2. Tıbbi cihazlar, akış
hızındaki düzensizlikleri önleyen ve/veya gösteren gereçlerle donatılmalıdır. Tıbbi cihazlar, enerji ve/veya
madde kaynağından gelen enerjinin kazara tehlikeli seviyeye gelmesini
önleyici uygun sistemle donatılmalıdır. 12.9. Kontrol ve gösterge
fonksiyonları, tıbbi cihazlar üzerinde açıkça belirtilmelidir. Tıbbi cihazın
üzerinde işleyiş için gerekli bilgiler veya işleyiş ve ayarlama parametreleri
bir görüntüleme sistemi yardımıyla belirtildiğinde, bu bilgiler kullanıcı ve
gerektiğinde hasta tarafından anlaşılır olmalıdır. 13) İmalatçı tarafından verilen
bilgiler: 13.1. Her bir tıbbi cihazın
beraberinde, potansiyel kullanıcıların eğitim ve bilgi düzeyi göz önüne
alınarak güvenli ve uygun bir kullanım sağlayan ve imalatçıyı tanımlayan
bilgiler yer almalıdır. Bu bilgiler kullanım
kılavuzunda ve etiket üzerinde detaylı olarak verilmelidir. Tıbbi cihazın güvenli
kullanımını sağlamak için gereken bilgiler, tıbbi cihazın üzerinde ve/veya
her bir parçasının ambalajı üzerinde veya gerektiğinde ticarî ambalaj
üzerinde de bulunmalıdır. Her bir parçanın ayrı ayrı
ambalajlanması mümkün değil ise, bu bilgiler bir veya birkaç tıbbi cihazın
broşüründe yer almalıdır. Her tıbbi cihazın ambalajında
kullanım kılavuzu bulunmalıdır. Sınıf I veya IIa
tıbbi cihazların kullanım kılavuzu olmadan güvenli kullanımı mümkün ise,
kullanım kılavuzu bulunmayabilir. 13.2. Bu bilgiler gerektiğinde
sembol şeklinde olabilir. Sembol ve tanıtıcı renkler uyumlaştırılmış
standartlara uygun olmalıdır. Standardı bulunmayanlar için sembol ve renkler
tıbbi cihazla birlikte verilen dokümanlarda açıklanmalıdır. 13.3. Etikette bulunması
gereken bilgiler: a) İmalatçının adı veya ticarî
adı ve adresi; ithal tıbbi cihazlar için, ayrıca yetkili temsilcinin ve/veya
ithalatçının adı veya ticarî adı ve adresi de etiket üzerinde veya satış
ambalajında ya da kullanım kılavuzunda yer almalıdır, b) Ambalajın içeriğini ve tıbbi
cihazı tanımlayıcı nitelikte olan ve özellikle kullanıcıya yönelik ayrıntılı
bilgiler, c) Gerektiğinde,
"STERİL" ibaresi, ç) Gerektiğinde,
"LOT" ifadesiyle birlikte parti kodu veya seri numarası, d) Gerektiğinde, ay ve yıl olarak
son kullanma tarihi, e) Gerektiğinde, "tek
kullanımlık" olduğu ibaresi, f) Tıbbi cihaz sipariş üzerine
yapılmış ise, "Ismarlama İmal Edilen Cihazdır" ibaresi, g) Klinik araştırma amaçlı
cihazlarda "Klinik Araştırmaya Mahsustur" ibaresi, ğ) Özel depolama ve/veya
kullanım şartları, h) Özel kullanım kılavuzu, ı) İkazlar ve/veya alınacak
önlemler, i) Aktif tıbbi cihazlar için
(d) alt bendinden ayrı olarak, parti/lot veya seri numarası içinde belirtilecek
imalat tarihi, j) Gerektiğinde, sterilizasyon
metodu, k) Radyoaktif madde içeren
taşıyıcı kap ve tıbbi cihazlar ile ilgili olarak Türkiye Atom Enerjisi
Kurumundan alınacak izin belgesine ilişkin bilgiler, l) Tıbbi cihazın bir insan kanı
türevi ihtiva etmesi durumunda bunu belirtir ibare aranır. 13.4. Tıbbi cihazın kullanım
amacı kullanıcı tarafından kolaylıkla anlaşılamıyorsa, imalatçı tıbbi cihazın
kullanım amacını etikette ve kullanım kılavuzunda açıkça belirtmelidir. 13.5. Gerektiğinde ve mümkünse;
aynı parti/lot içindeki tıbbi cihaz ve bileşenlerinden kaynaklanabilecek
herhangi bir potansiyel tehlikeye sebep olabilecek bütün durumlar kullanım
kılavuzunda açıkça belirtilmelidir. 13.6. Gerektiğinde, kullanım
kılavuzu aşağıdaki bilgileri içermelidir: a) Bu Ekin (13.3) numaralı
kısmında belirtilen, (ç) ve (d) alt bentleri dışındaki, tüm ayrıntılar, b) Bu Ekin (3) numaralı
kısmında belirtilen performans ve istenmeyen yan etkiler, c) Tıbbi cihazın kullanım
amacına uygun olarak çalıştırılması için, diğer tıbbi cihazlarla veya
donanımlarla birlikte yerleştirilmesi veya bağlanması gerekiyorsa, güvenli
bir bütünlüğü sağlamak amacıyla gerekli olan bütün özellikler ve yeterli
bilgiler, ç) Tıbbi cihazın kurulumunun
uygun olup olmadığı ve doğru ve emniyetli olarak çalışıp çalışmayacağının
doğrulanması için gerekli olan bütün bilgiler ile tıbbi cihazların her zaman
uygun ve güvenli olarak çalışmasını sağlamak için gerekli olan bakım ve
kalibrasyonun niteliği ve sıklığı hakkındaki bütün bilgiler, d) Gerektiğinde, tıbbi cihazın implantasyonuna bağlı oluşabilecek ciddi tehlikelerden
kaçınmayı sağlayan bilgiler, e) Spesifik tedavi veya
araştırma sırasında tıbbi cihazdan kaynaklanan karşılıklı etkileşim
tehlikeleriyle ilgili bilgiler, f) Steriliteyi
sağlayan ambalajın bozulması halinde ve gerektiğinde yeniden sterilizasyon
metotlarının uygulanmasına ait gerekli bilgiler, g) Tıbbi cihaz yeniden
kullanılabilir bir tıbbi cihaz ise; temizlenmesi, dezenfekte edilmesi ve
yeniden sterilizasyonu gerekiyorsa, sterilizasyon metodu dahil gerekli
yöntemlere ilişkin bilgilendirmeler ve yeniden kaç kez kullanılabileceğine
ilişkin bilgiler, Tıbbi cihazın kullanılmadan
önce steril edilmesi gerekiyorsa, imalatçı tarafından verilen temizleme ve
sterilizasyon ile ilgili talimatlar doğru şekilde uygulandığında, tıbbi cihaz
bu Ekin "Genel Gerekler" ini halen karşılıyor olmalıdır, Tek kullanımlık tıbbi
cihazlarda, tıbbi cihazın yeniden kullanılması halinde oluşacak risk hakkında
imalatçı tarafından bilinen teknik unsurlara ve özelliklere ilişkin bilgiler
kullanım kılavuzunda yer almalıdır. Bu Ekin13.1. numaralı kısmına uygun
olarak kullanım kılavuzu gerekmediği durumlarda söz konusu bilgiler, talebi
halinde kullanıcıya verilmelidir. ğ) Tıbbi cihaz kullanıma hazır
olmadan önce gerekli bütün işlem veya işleyişle ilgili detaylar (örneğin
sterilizasyon, son montaj), h) Tıbbi amaçlı radyasyon yayan
tıbbi cihazlarda; radyasyonun dağılımı, yoğunluğu, tipi ve niteliği hakkında
detaylı bilgiler, Kullanım kılavuzu aynı zamanda,
sağlık personelinin, hastaları kontrendikasyonlar
ve alınacak tedbirler konusunda bilgilendirmesine yönelik ayrıntıları da
içermelidir. Bu ayrıntılar özellikle aşağıdaki hususları kapsamalıdır: ı) Tıbbi cihazın performansında
değişiklik olduğunda alınacak önlemler, i) Manyetik alanlarda, harici
elektriksel etkilerde, elektrostatik deşarjda, basınç veya basınç
değişimlerinde, ivme, termik ateşleme kaynakları gibi önceden tahmin
edilebilen çevre koşullarında meydana gelebilecek değişikliklere maruz kalma
durumunda alınacak tedbirler, j) Tıbbi ürün veya ürünleri
vermeye yönelik tıbbi cihazlar üzerinde, uygulanacak olan maddenin
seçimindeki kısıtlamaları da içeren, ürünle ilgili gerekli bütün bilgiler, k) Tıbbi cihazın imhası
sırasında meydana gelebilecek, özel veya beklenmeyen tehlikelere karşı alınacak
tedbirler, l) Bu Ekin (7.4) numaralı
kısmına göre, bir entegre parça olarak uygulanacak tıbbi maddeler veya insan
kanı türevleri, m) Ölçüm fonksiyonlu tıbbi
cihazlar için öngörülen doğruluk derecesi, n) Kullanım kılavuzunun basım
tarihi veya en son güncelleme bilgisi. EK II AT UYGUNLUK BEYANI (Tam Kalite Güvence Sistemi) 1) İmalatçı, tıbbi cihazların
tasarımı, imalatı ve nihaî kontrolleri için, bu Ekin (3) numaralı kısmında
belirtilen onaylanan kalite sisteminin uygulanmasını sağlar; ayrıca, gözetim
ve denetim hususunda, bu Ekin (3.3), (4) ve (5) numaralı kısımlarında
belirtilen işlemlere tâbidir. 2) AT Uygunluk Beyanı (EC Declaration of Conformity) bu
Ekin (1) numaralı kısmında belirtilen zorunlulukları yerine getiren
imalatçının, söz konusu ürünlerin bu Yönetmelik hükümlerine uygun olduğunu
temin ve beyan ettiğini gösteren işlemdir. Buna göre imalatçı, bu
Yönetmeliğin 17 nci maddesine uygun olarak CE
işaretini iliştirir ve yazılı bir uygunluk beyanı hazırlar. İmalatçı
tarafından muhafaza edilecek olan bu beyan, imal edilen tüm tıbbi cihazları
içermeli ve söz konusu cihazlar ürün adı, ürün kodu veya diğer ibarelerle
açıkça tanımlanmalıdır. 3) Kalite sistemi: 3.1. İmalatçı, kalite
sisteminin değerlendirilmesi için onaylanmış kuruluşa başvurur. Bu başvuru
aşağıdaki hususları içerir: - İmalatçının adı ve adresi,
kalite sistemi içinde yer alan diğer bütün imalat yerlerinin adı ve adresleri, - İşleme esas tıbbi cihaz veya
tıbbi cihaz grubu ile ilgili bütün bilgiler, - Aynı tıbbi cihazlar hakkında
başka bir onaylanmış kuruluşa başvuru yapılmadığına dair yazılı beyan, - Kalite sistemi hakkında
belgeler, - İmalatçının, onaylanan kalite
sisteminin gereklerini yerine getirme taahhüdü, - Onaylanan kalite sisteminin
eksiksiz ve etkili olarak sürdürüleceğine dair imalatçı taahhüdü, - Üretim sonrası aşamada tıbbi
cihazlardan elde edilen verilerin, Ek Xdaki
hükümler de dâhil olmak üzere, gözden geçirilmesi, gerekli düzeltici
faaliyetlerin uygulanması amacıyla bir sistem oluşturulması ve bu sistemin
güncel tutulmasına dair imalatçı taahhüdü. Bu taahhüt, imalatçının aşağıda
belirtilen durumlardan bilgisi olduğu andan itibaren Bakanlığı derhal
haberdar etme zorunluluğunu kapsar: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması, 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) (a) bendinde belirlenen
nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından piyasadan
sistematik olarak geri çekilmesine yol açan tıbbi cihazın özelliğine ve
performansına bağlı teknik ve tıbbi sebepler. 3.2. Kalite Sistemi Uygulaması,
tasarımdan nihaî kontrole kadar bütün aşamalarda, tıbbi cihazların bu
Yönetmelik hükümlerine uygun olduğunu garanti etmelidir. Kalite sistemi için,
imalatçı tarafından benimsenen bütün şartlar, gerekler ve unsurlar, kaliteye
ilişkin kayıtlar, yapılan işler, planlar, programlar, yazılı, sıralı ve
sistematik bir şekilde bir belgede yer almalıdır. Bu kalite sistem
belgelendirmesi, aşağıdaki hususların yanı sıra (c) bendinde belirtilen
işlemlerden elde edilen belgeleri, verileri ve kayıtları bilhassa
içermelidir. a) İmalatçının kalite
hedefleri, b) İşletmenin organizasyon
yapısı ve özellikle; - Tıbbi cihazın tasarım
kalitesi ve imalatı konusunda yetkililerin ve çalışanların sorumlulukları,
yetkileri ve kurumsal yapılanma, - Uygun olmayan tıbbi
cihazların kontrolü dâhil, tıbbi cihazların ve tasarımlarının istenen
kalitede olması için kalite sisteminin etkin işleyişini kontrol etmeyi
sağlayan metotlar, - Tıbbi cihazın veya
parçalarının tasarımı, imalatı ve/veya nihai muayene ve test işlemleri üçüncü
taraflarca yapılıyor ise, kalite sisteminin etkin işleyişinin ve özellikle de
söz konusu üçüncü tarafa uygulanan kontrolün şeklinin ve kapsamının
izlenmesine yönelik yöntemler; c) Tıbbi cihazların tasarımının
izlenmesi ve doğrulanması işlemleri, bununla ilgili belgeleri ve özellikle
aşağıdaki hususları; - Öngörülen değişiklikler
dâhil, tıbbi cihazın genel tanımı ve kullanım amaçları, - Bu Yönetmeliğin 7 nci maddesinde belirtilen standartlar tümüyle
uygulanmadığında, tıbbi cihazların temel gerekleri karşılaması için
benimsenen çözümlerin tanımı da dâhil risk analizi sonuçları ve uygulanacak
standartları içeren tasarım özellikleri, - Tıbbi cihazların tasarımı
esnasında kullanılacak olan sistematik ölçümler, işlemler ile tasarım kontrol
ve doğrulama teknikleri, - Tıbbi cihazın, amacına uygun
olarak çalışabilmesi için başka tıbbi cihaz(lar)a
bağlanması söz konusu ise, imalatçıları tarafından belirlenen özellikleri
taşıyan bu tıbbi cihaz(lar)ın
birbiriyle bağlandığı durumlarda temel gereklere uygun olduğunun kanıtı, - Ek I/7.4de bahsedilen ve
tıbbi cihazın, bir bütünün parçası olarak insan kanı türevi veya bir maddeyi
ihtiva edip etmediğini gösteren ifade ile tıbbi cihazın öngörülen amacı
dikkate alınarak insan kanı türevi veya maddenin kullanışlılığının,
kalitesinin ve güvenilirliğinin değerlendirilmesi için gereken test
sonuçlarına ait veriler, - Tıbbi cihazın imalatında,
hayvan kaynaklı dokularla ilgili düzenlemelere uygun olarak hayvan kaynaklı
dokuların kullanılıp kullanılmadığına ilişkin beyan, - Ek Iin
(2) numaralı kısmına uygun olarak benimsenen çözümler, - Klinik öncesi değerlendirme, - Ek Xda
belirtilen klinik değerlendirme, - Etiket ve gerekiyor ise
kullanım kılavuzu taslağı ç) İmalat aşamasındaki muayene
ve kalite güvencesi teknikleri; - Özellikle sterilizasyon ve
satın alma konusunda kullanılacak süreçler, işlemler ve ilgili belgeler, - İmalatın her aşamasındaki
çizimlerden, özelliklerden veya diğer ilgili belgelerden yararlanarak
hazırlanan ve güncel tutulan, tıbbi cihaz tanımlama işlemleri, d) İmalat öncesinde, esnasında
ve sonrasında yapılacak uygun test ve denemeler, bunların hangi sıklıkla yapılacağı,
kullanılan test cihazları ve test cihazlarının kalibrasyonunun geriye doğru
izlenmesini mümkün kılacak hususları. 3.3. Onaylanmış kuruluş, kalite
sisteminin bu Ekin (3.2) numaralı kısmında belirtilen gereklere uygun olup
olmadığını saptamak için denetimini yapar. İlgili uyumlaştırılmış
standartların uygulandığı kalite sistemlerinin, söz konusu gereklere uygun
olduğu kabul edilir. Değerlendirme ekibinde en az
bir üyenin, ilgili teknoloji hakkında değerlendirme deneyimi olmalıdır.
Değerlendirme işlemi, tıbbi cihazın tasarımına ilişkin belgelerin numune
bazında değerlendirilmesini ve imalat süreçlerinin denetimi için imalatçının,
gerektiğinde imalatçının tedarikçisinin ve/veya yüklenicisinin yerinde
denetimini içermelidir. Karar, denetim sonuçları ve açıklamalı
değerlendirmeyle birlikte imalatçıya tebliğ edilir. 3.4. İmalatçı, kalite sistemine
veya tıbbi cihaz çeşidine getirmeyi planladığı önemli değişikliklere ilişkin
bütün tasarıları hakkında, kalite sistemini onaylayan onaylanmış kuruluşa
bilgi verir. Onaylanmış kuruluş, teklif edilen değişiklikleri değerlendirir
ve kalite sistemindeki bu değişikliklerin bu Ekin (3.2) numaralı kısmında
belirtilen gereklere uyup uymadığını inceler ve kararını imalatçıya tebliğ
eder. Bu karar, denetimin sonuçlarını ve açıklamalı değerlendirmeyi de
kapsar. 4) Tıbbi cihaz tasarımının
incelenmesi: 4.1. İmalatçı, bu Ekin (3)
numaralı kısmında belirtilen gereklere ilaveten, bu Ekin (3.1) numaralı
kısmına göre imalatını planladığı tıbbi cihazın tasarım dosyasını incelenmek
üzere onaylanmış kuruluşa verir. 4.2. Başvuru, söz konusu tıbbi
cihazın tasarımını, imalatını ve performansını tanımlamalı ve bu Ekin (3.2)
numaralı kısmının (c) alt bendinde belirtildiği gibi, tıbbi cihazın bu
Yönetmeliğin gereklerine uygunluğunun değerlendirilmesi için gerekli
belgeleri içermelidir. 4.3. Onaylanmış kuruluş
başvuruyu inceler ve tıbbi cihaz bu Yönetmelik hükümlerine uygun ise, başvuru
sahibine AT Tasarım-İnceleme Sertifikası (EC Design-Examination Certificate) verir.
Onaylanmış kuruluş, bu Yönetmeliğin gereklerine uygunluğun değerlendirilmesi
amacıyla başvuru sürecinde ilave kanıtlar ve deneyler isteyebilir. Sertifika;
inceleme sonuçlarını, geçerlilik şartlarını, onaylanan tasarımın tanımında
gerekli verileri ve gerektiğinde tıbbi cihazın amacını da kapsar. Ek I/7.4ün ikinci paragrafında
belirtilen tıbbi cihazlar söz konusu olduğunda, onaylanmış kuruluş anılan
bölümde bahsedilen durum hakkında bir karar almadan önce Bakanlığa veya
Avrupa Tıbbi Ürünler Değerlendirme Ajansına (EMEA) danışır. Bakanlık veya
Avrupa Tıbbi Ürünler Değerlendirme Ajansı (EMEA) geçerli belgelerin kendisine
teslim edildiği tarihten itibaren 210 (ikiyüzon)
gün içinde görüş verir. Söz konusu bilimsel görüş, tıbbi cihazla ilgili
belgelendirmede yer alır. Onaylanmış kuruluş, kararını verirken bilimsel
görüşte ifade edilen hususları göz önünde bulundurur ve nihaî kararını Bakanlığa
ve/veya Avrupa Tıbbi Ürünler Değerlendirme Ajansına (EMEA) iletir. Ek I/7.4ün üçüncü paragrafında
belirtilen tıbbi cihazlar söz konusu olduğunda, tıbbi cihaz ile ilgili
belgelere Avrupa Tıbbi Ürünler Değerlendirme Ajansının (EMEA) bilimsel görüşü
de dâhil edilmelidir. Avrupa Tıbbi Ürünler Değerlendirme Ajansı (EMEA)
bilimsel görüşünü, geçerli belgelerin kendisine teslim edildiği tarihten
itibaren 210 (ikiyüzon) gün içinde verir.
Onaylanmış kuruluş kararını verirken Avrupa Tıbbi Ürünler Değerlendirme
Ajansının (EMEA) görüşünü göz önünde bulundurur. Şayet, Avrupa Tıbbi Ürünler
Değerlendirme Ajansının (EMEA) bilimsel görüşü olumlu değil ise, onaylanmış
kuruluş, sertifikayı vermeyebilir. Onaylanmış kuruluş nihai kararını Avrupa
Tıbbi Ürünler Değerlendirme Ajansına (EMEA) iletir. Onaylanmış kuruluş, hayvan
kaynaklı dokular kullanılarak imal edilen tıbbi cihazlar söz konusu
olduğunda, bunlara ilişkin düzenlemelerde yer alan işlemleri yürütür. 4.4. Tasarım değişiklikleri
durumunda, bu Yönetmeliğin temel gereklerine uygunluğunun veya tıbbi cihazın
kullanımına ilişkin koşulların etkilenmesi halinde, AT Tasarım-İnceleme
Sertifikasını veren onaylanmış kuruluştan ilave bir onay alınmalıdır. Başvuru
sahibi, onaylanan tasarım ile ilgili bütün değişiklikleri onaylanmış kuruluşa
bildirir. AT Tasarım-İnceleme Sertifikasına ilave olarak "ek onay"
alır. 5) Gözetim ve denetim: 5.1. Gözetim ve denetimin
amacı, imalatçının, onaylanan kalite sisteminin gereklerini tam olarak yerine
getirmesini sağlamaktır. 5.2. İmalatçı, onaylanmış
kuruluşu gerekli bütün denetimleri yapması için yetkilendirir ve ona gereken
bütün bilgileri temin eder. Bu bilgiler: - Kalite sistemine ilişkin belgeler, - Kalite sisteminin tasarımla
ilgili bölümünde öngörülen analiz sonuçları, hesaplamalar, testler, Ek Iin (2) numaralı kısmında yer alan çözümler, klinik
öncesi ve klinik değerlendirmeler, piyasaya arz sonrası klinik izleme planı
ve sonuçları gibi veriler, - Kalite sisteminin imalatla
ilgili bölümünde öngörülen muayene raporları, test verileri, kalibrasyon
verileri ve ilgili personelin nitelikleri hakkındaki raporlar gibi veriler. 5.3. Onaylanmış kuruluş,
imalatçının onaylanan kalite sistemine uymasını sağlamak amacıyla periyodik
olarak denetim ve değerlendirme yapar, imalatçıya değerlendirme raporu verir. 5.4. Onaylanmış kuruluş,
imalatçıya habersiz ziyaretler yapabilir. Bu ziyaretlerde gerekli görür ise,
kalite sisteminin iyi işlediğini denetlemek için testler yapabilir veya
yaptırabilir. İmalatçıya bir denetim raporu ile eğer yapılmışsa test raporu
verilir. 6) İdarî hükümler: 6.1. İmalatçı veya yetkili
temsilcisi Bakanlığa ibraz etmek üzere, imal edilen son tıbbi cihazın imalat
tarihinden itibaren en az 5 (beş) yıl ve vücuda yerleştirilebilir cihazlar
için en az 15 (onbeş) yıl süreyle aşağıdaki
belgeleri saklar: - Uygunluk beyanı, - Bu Ekin (3.1) numaralı
kısmında belirtilen kalite sistemi belgeleri ve özellikle (3.2) numaralı
kısmın ikinci paragrafında yer alan belgeler, veriler ve kayıtlar, - Bu Ekin (3.4) numaralı
kısmında belirtilen değişiklikler, - Bu Ekin (4.2) numaralı
kısmında belirtilen belgeler, - Bu Ekin (3.3), (4.3), (4.4),
(5.3) ve (5.4) numaralı kısımlarında belirtilen onaylanmış kuruluş kararları
ve raporları. 7) Sınıf IIa
ve IIb tıbbi cihazlar için uygulama: 7.1. (4) numaralı kısmı hariç
olmak üzere bu Ek, bu Yönetmeliğin 11 inci maddesinde belirtilen Sınıf IIa ve IIb tıbbi cihazlara
uygulanabilir. 7.2. Sınıf IIa
tıbbi cihazlar için, onaylanmış kuruluş, (3.3) numaralı kısımda yer alan
değerlendirmenin bir parçası olarak, bu Yönetmelik hükümlerine uygunluk
bakımından her bir cihaz alt kategorisinden en az bir numune için (3.2) numaralı
kısmın (c) alt bendinde yer alan teknik belgeleri değerlendirir. 7.3. Sınıf IIb
tıbbi cihazlar için, onaylanmış kuruluş, (3.3) numaralı kısımda yer alan
değerlendirmenin bir parçası olarak, bu Yönetmelik hükümlerine uygunluk
bakımından her bir jenerik cihaz grubundan en az bir numune için (3.2) numaralı
kısmın (c) alt bendinde yer alan teknik belgeleri değerlendirir. 7.4. Onaylanmış kuruluş, numune
seçiminde, teknolojik yenilikleri, tasarımdaki benzerlikleri, teknolojiyi,
imalat ve sterilizasyon yöntemlerini, kullanım amacını ve bu Yönetmeliğe
uygun olarak geçmişte yapılmış değerlendirme sonuçlarını (ör. fiziksel,
kimyasal ve biyolojik özellikler bakımından) dikkate alır. Onaylanmış
kuruluş, alınan numunelere yönelik gerekçeyi Bakanlığa sunmak üzere hazır
bulundurur. 7.5. Onaylanmış kuruluş, (5)
numaralı kısımda belirtilen gözetim ve denetim değerlendirmesi kapsamında
başka numuneleri de inceler. 8) İnsan kanı türevi ihtiva
eden tıbbi cihazlara yönelik uygulama: İnsan kanı türevi ihtiva eden
tıbbi cihazlardan her bir partinin/lotun imalatı tamamlandığında, imalatçı,
onaylanmış kuruluşu tıbbi cihaz partisinin/lotunun piyasaya arzı konusunda
bilgilendirir ve bunların piyasaya arzı ile ilgili olarak devlet laboratuvarı veya Bakanlıkça belirlenen başka bir laboratuvar tarafından Beşeri Tıbbi Ürünler
Ruhsatlandırma Yönetmeliği hükümlerine göre verilen resmî sertifikayı
onaylanmış kuruluşa gönderir. EK III AT TİP İNCELEMESİ 1) AT Tip incelemesi; üretimi
temsil eden numunenin bu Yönetmelik hükümlerine uygunluğunun onaylanmış kuruluş
tarafından belgelendirilmesi işlemidir. 2) Başvuru şu hususları içerir: - İmalatçının adı ve adresi;
başvuru, yetkili temsilci tarafından yapılmışsa yetkili temsilcinin adı ve
adresi, - Bu Yönetmelik hükümlerinde
tip olarak tanımlanan üretimi temsil eden numunenin uygunluk
değerlendirmesi için bu Ekin (3) numaralı kısmında belirtilen belgeler,
onaylanmış kuruluşa verilmek üzere hazırlanan bir tip ile onaylanmış
kuruluş talep ettiğinde verilecek başka numuneler, - Aynı tip için başka bir
onaylanmış kuruluşa başvuru yapılmadığına dair yazılı beyan. 3) Verilen belgeler; tasarım,
imalat ve tıbbi cihaz performanslarının anlaşılmasını sağlamalı ve aşağıdaki
hususları içermeli: - Planlanan değişiklikler de
dâhil olmak üzere, tipin genel bir tanımını ve kullanım amacını, - Tasarım çizimleri, özellikle
sterilizasyonla ilgili öngörülen imalat metotları ile bileşenler, alt gruplar
ve devreleri gösteren ayrıntılı şema, - Tıbbi cihazın çalışması,
çizim ve şemaların anlaşılması için gerekli tanım ve açıklamalar, - Bu Yönetmeliğin 7 nci maddesinde belirtilen standartlardan tam veya kısmen
uygulananların bir listesi ile bu standartlar uygulanmadığında, bu
Yönetmeliğin temel gereklerini karşılamak için benimsenen çözümlerin tanımı, - Tasarım hesaplamaları, risk
analizleri, incelemeler, teknik testler gibi yapılan işlemlerin sonuçları, - Tıbbi cihazın kullanım amacı
dikkate alınarak, Ek I/7.4de belirtilen bir madde veya insan kanı türevinin
bir bütünün parçası olarak tıbbi cihazın yapısında yer alıp almadığına
ilişkin beyan ile bu madde veya insan kanı türevinin güvenilirliği, kalitesi
ve kullanışlılığını değerlendirmek için yapılan testlere ait veriler, - Tıbbi cihazın imalatında,
hayvan kaynaklı dokularla ilgili düzenlemelere uygun olarak hayvan kaynaklı
dokuların kullanılıp kullanılmadığına ilişkin beyan, - Ek Iin
(2) numaralı kısmına uygun olarak benimsenen çözümler, - Klinik öncesi değerlendirme, - Ek Xda
belirtilen klinik değerlendirme, - Etiket ve gerekiyor ise
kullanım kılavuzu taslağı. 4) Onaylanmış kuruluş: 4.1. İbraz edilen belgelerin,
tipe uygunluğunu ve tipin de belgelere uygun olarak imal edilip edilmediğini,
bu Yönetmeliğin 7 nci maddesinde belirtilen
standartların uygulanabilir hükümlerine uyulup uyulmadığını inceler,
değerlendirir ve değerlendirme sonuçlarını kaydeder. 4.2. Bu Yönetmeliğin 7 nci maddesinde belirtilen standartların uygulanmadığı
tıbbi cihazlar için imalatçının tavsiye ettiği çözümlerin bu Yönetmeliğin
temel gereklerini karşılayıp karşılamadığını doğrulamak amacıyla uygun
muayene ve testleri yapar veya yaptırır. Şayet, tıbbi cihazın kullanım
amacına uygun olarak çalışabilmesi için başka tıbbi cihaz(lar)a
bağlanması gerekiyorsa, imalatçı tarafından belirtilen özelliklere sahip
tıbbi cihaz(lar)a bağlandığında temel gereklere
uygunluğu da kanıtlanmalıdır. 4.3. İmalatçının halen yürürlükte
olan ilgili standartları seçmesi halinde, bu standartların gerçekten
uygulanıp uygulanmadığını değerlendirmek için gerekli muayene ve testleri
yapar veya yaptırır. 4.4. Gerekli muayene ve
testlerin uygulanacağı yeri başvuru sahibi ile birlikte belirler. 5) Onaylanmış kuruluş: Bu Yönetmelik hükümlerini yerine getiren
imalatçıya AT Tip-İnceleme Sertifikasını (EC Type-Examination Certificate) verir.
Sertifika, imalatçının adı ve adresini, denetim sonuçlarını, geçerlilik
şartlarını ve onaylanan tip tanımlanması için gerekli verileri içerir.
Belgenin ilgili bölümleri sertifikaya eklenir ve bir kopyası onaylanmış
kuruluş tarafından saklanır. Ek I/7.4ün ikinci paragrafında
belirtilen tıbbi cihazlar söz konusu olduğunda, onaylanmış kuruluş bu bölümde
bahsedilen durum hakkında bir karar almadan önce Bakanlığa veya Avrupa Tıbbi
Ürünler Değerlendirme Ajansına (EMEA) danışır. Bakanlık veya Avrupa Tıbbi
Ürünler Değerlendirme Ajansı (EMEA) bilimsel görüşünü, geçerli belgelerin
kendisine teslim edildiği tarihten itibaren 210 (ikiyüzon)
gün içinde verir. Söz konusu görüş, tıbbi cihazla ilgili belgelendirmede yer
alır. Onaylanmış kuruluş, kararını verirken bilimsel görüşte ifade edilen
hususları göz önünde bulundurur ve nihaî kararını Bakanlığa ve/veya Avrupa
Tıbbi Ürünler Değerlendirme Ajansına (EMEA) iletir. Ek I/7.4ün üçüncü paragrafında
belirtilen tıbbi cihazlar söz konusu olduğunda, tıbbi cihaz ile ilgili
belgelere Avrupa Tıbbi Ürünler Değerlendirme Ajansının (EMEA) bilimsel görüşü
de dâhil edilmelidir. Avrupa Tıbbi Ürünler Değerlendirme Ajansı (EMEA)
bilimsel görüşünü, geçerli belgelerin kendisine teslim edildiği tarihten
itibaren 210 (ikiyüzon) gün içinde verir.
Onaylanmış kuruluş kararını verirken Avrupa Tıbbi Ürünler Değerlendirme
Ajansının (EMEA) bilimsel görüşünü göz önünde bulundurur. Şayet, Avrupa Tıbbi
Ürünler Değerlendirme Ajansının (EMEA) görüşü olumlu değil ise, onaylanmış
kuruluş, sertifikayı vermeyebilir. Onaylanmış kuruluş nihai kararını Avrupa
Tıbbi Ürünler Değerlendirme Ajansına (EMEA) iletir. Onaylanmış kuruluş, hayvan
kaynaklı dokular kullanılarak imal edilen tıbbi cihazlar söz konusu
olduğunda, bunlara ilişkin düzenlemelerde yer alan işlemleri yürütür. 6) Başvuru sahibi onaylanan
üründe yapılan bütün önemli değişiklikleri, AT Tip-İnceleme Sertifikası veren
onaylanmış kuruluşa bildirmek zorundadır. Tasarım değişiklikleri bu
Yönetmeliğin temel gereklerine uygunluğu veya ürünün kullanımı için
belirtilen şartları etkiliyorsa, bu değişiklikler için AT Tip-İnceleme
Sertifikasını veren onaylanmış kuruluştan ek onay alınmalıdır. Başvuru
sahibi, gerektiğinde, ilk AT Tip-İnceleme Sertifikasına ilaveten ek onay
alır. 7) İdarî hükümler: 7.1. Diğer onaylanmış
kuruluşlar AT Tip-İnceleme Sertifikaları ve/veya bunların eklerinden bir
kopya alabilir. Sertifikanın ekleri, imalatçının bilgisi dâhilinde, gerekçeli
talep üzerine diğer onaylanmış kuruluşlara verilir. 7.2. İmalatçı veya yetkili
temsilcisi, son tıbbi cihazın imalatından itibaren en az 5 (beş) yıl boyunca
teknik belgelerle birlikte AT Tip-İnceleme Sertifikası ve bunların
tamamlayıcı ek belgelerinin bir kopyasını saklar. Vücuda yerleştirilebilir
cihazlar için söz konusu saklama süresi son tıbbi cihazın imalatından
itibaren en az 15 (onbeş) yıldır. EK IV AT DOĞRULAMASI 1) AT doğrulaması; imalatçının
veya yetkili temsilcisinin, bu Ekin (4) numaralı kısmında açıklanan işlemlere
tâbi olan tıbbi cihazların AT Tip-İnceleme Sertifikasında tanımlanan tipe
uyduğunu ve bunlarla ilgili Yönetmelik hükümlerine uygun olduğunu beyan ve
garanti ettiği işlemdir. 2) İmalatçı, üretilen tıbbi
cihazların, bu Yönetmelik hükümlerine ve AT Tip-İnceleme Sertifikasında
tanımlanan tipin bütün özelliklerine tamamen uygun olması için imalat
yöntemiyle ilgili gerekli tedbirleri alır. İmalatçı, imalata başlamadan önce,
imalat sürecini özellikle gerekli sterilizasyon konusunu, tüm rutin
işlemleri, üretimin homojenliğini sağlamak için öngörülen hükümleri, mümkün
olduğunda tıbbi cihazın AT Tip-İnceleme Sertifikasında tanımlanan tip ile
Yönetmeliğin ilgili gereklerine uygunluğunu gösteren belgeleri hazırlar.
İmalatçı, Yönetmeliğin 17 nci maddesine göre CE
işaretini iliştirir ve uygunluk beyanı düzenler. Ek olarak imalatçı, piyasaya
steril halde arz edilen tıbbi cihazlarda, yalnızca sterilitenin
güvenceye alınması ve sürdürülmesi amaçlı imalat süreçleri için Ek Vin (3) ve (4) numaralı kısımlarının hükümlerini
uygular. 3) İmalatçı üretim sonrası
aşamada tıbbi cihazlardan elde edilen verilerin, Ek Xda
yer alan hükümler de dâhil olmak üzere, gözden geçirilmesi ve gerekli
düzeltici faaliyetlerin uygulanması amacıyla bir sistem oluşturulması ve bu
sistemin güncel tutulmasından sorumludur. Bu kapsamda imalatçının aşağıda
belirtilen durumlardan bilgisi olduğu andan itibaren Bakanlığı derhal
haberdar etme yükümlülüğü de bulunmaktadır: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması, 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) (a) bendinde belirlenen
nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından piyasadan
sistematik olarak geri çekilmesine yol açan tıbbi cihazın özelliğine ve
performansına bağlı teknik ve tıbbi sebepler. 4) Onaylanmış kuruluş,
imalatçının kararına göre, bu Ekin (5) numaralı kısmında belirtildiği gibi
her bir tıbbi cihazı test ve kontrol ederek veya (6) numaralı kısmında
belirtildiği gibi ürünlerin istatistiksel doğrulamasını yaparak, Yönetmeliğin
öngördüğü gereklerin yerine getirilip getirilmediğini doğrulamak amacıyla uygun
test ve incelemeleri gerçekleştirir. Yukarıda bahsedilen kontroller
sterilizasyonu güvenceye almak amacıyla tasarlanmış imalat sürecinde
uygulanmaz. 5) Her bir tıbbi cihazın test
ve kontroller ile doğrulanması: 5.1. Her tıbbi cihaz ayrı ayrı incelenir. Mümkün olduğunda, tıbbi cihazın AT
Tip-İnceleme Sertifikasında tanımlanan tip ile Yönetmeliğin ilgili
gereklerine uygunluğunu doğrulamak için bu Yönetmeliğin 7 nci
maddesinde öngörülen ilgili standartlarda tanımlanan uygun testler veya
eşdeğer testler yapılır. 5.2. Onaylanmış kuruluş,
onaylanan her bir tıbbi cihaza kendi kimlik numarasını basar veya bastırır ve
gerçekleştirilen bütün testler ile ilgili yazılı bir uygunluk sertifikası
düzenler. 6) İstatistiksel doğrulama: 6.1. İmalatçı, nihai ürünleri
homojen parti/lot numaraları ile sunmalıdır. 6.2. Her partiden/lottan
rastgele numune alınır. Bu numuneler, ayrı ayrı
incelenir. Partinin/lotun kabul veya reddedildiğini tespit etmek amacıyla
mümkün olduğunda, tıbbi cihazın AT Tip-İnceleme Sertifikasında tanımlanan tip
ile Yönetmeliğin ilgili gereklerine uygunluğunu doğrulamak için bu
Yönetmeliğin 7 nci maddesinde öngörülen ilgili
standartlarda tanımlanan uygun testler veya eşdeğer testler yapılır. 6.3. Tıbbi cihazın
istatistiksel kontrolü, en son teknolojiye uygun olarak yüksek düzeyde
güvenlik ve performans sağlayan işlevsel özellikli örnekleme şemalarına
ihtiyaç duyan niteliklere ve/veya değişkenlere dayanılarak yapılır. Bu örnekleme
şeması, söz konusu cihaz kategorisinin özel niteliği dikkate alınarak, Yönetmeliğin
7 nci maddesinde belirtilen ilgili standartlara
göre oluşturulur. 6.4. Eğer parti/lot kabul
edilirse, onaylanmış kuruluş her bir tıbbi cihazın üzerine kendi kimlik
numarasını basar veya bastırır ve gerçekleştirilen testler ile ilgili yazılı
uygunluk sertifikası düzenler. Kabul edilen partideki/lottaki, uygun olmayan
numuneler haricindeki tüm tıbbi cihazlar piyasaya arz edilebilir. Eğer bir parti/lot
reddedilirse, onaylanmış kuruluş bu partinin/lotun piyasaya arzını engellemek
için gerekli tedbirleri alır. Partinin/lotun sıklıkla reddedilmesi durumunda,
onaylanmış kuruluş istatistiksel doğrulamaya ara verebilir. İmalatçı, onaylanmış kuruluşun
sorumluluğu altında, imalat işlemleri sırasında onaylanmış kuruluşun kimlik
numarasını basabilir. 7) İdarî hükümler: İmalatçı veya yetkili
temsilcisi Bakanlığa ibraz etmek üzere, son tıbbi cihazın imalat tarihinden
itibaren en az 5 (beş) yıl ve vücuda yerleştirilebilir cihazlar için en az 15
(onbeş) yıl süreyle aşağıdaki belgeleri saklar: - Uygunluk beyanı, - Bu Ekin (2) numaralı kısmında
belirtilen belgeler, - Bu Ekin (5.2) ve (6.4)
numaralı kısımlarında belirtilen belgeler, - Gerektiğinde, Ek IIIde belirtilen AT Tip-İnceleme Sertifikası. 8) Sınıf IIa
tıbbi cihazlar için uygulama: Bu Ek, aşağıdaki hususlar dikkate
alınarak, Yönetmeliğin 11 inci maddesindeki Sınıf IIa
tıbbi cihazlara uygulanabilir. 8.1. İmalatçı, bu Ekin (1) ve
(2) numaralı kısımları hariç, Sınıf IIa ürünlerini
Ek VIInin (3) numaralı kısmında belirtilen teknik
belgelere uygun olarak imal ettiğini ve bu Yönetmeliğin ilgili gereklerini
karşıladığını, uygunluk beyanı ile garanti eder ve açıklar. 8.2. Bu Ekin (1), (2), (5) ve
(6) numaralı kısımları hariç, onaylanmış kuruluşça Ek VIInin
(3) numaralı kısmında belirtilen teknik belgeler ile gerçekleştirilen
doğrulamalar Sınıf IIa ürünlerin uygunluğunu teyit
etmek amaçlıdır. 9) İnsan kanı türevi ihtiva
eden tıbbi cihazlara yönelik uygulama: İnsan kanı türevi ihtiva eden
tıbbi cihazlarda, her bir tıbbi cihaz partisinin/lotunun imalatının
tamamlanması ve (6) numaralı kısma göre doğrulanması söz konusu olduğunda,
imalatçı, onaylanmış kuruluşu bu tıbbi cihaz partisinin/lotunun piyasaya arzı
konusunda bilgilendirir ve bunların piyasaya arzı ile ilgili olarak devlet laboratuvarı veya Bakanlıkça belirlenen bir başka laboratuvar tarafından Beşeri Tıbbi Ürünler
Ruhsatlandırma Yönetmeliği hükümlerine göre düzenlenen resmî sertifikayı
onaylanmış kuruluşa gönderir. EK V AT UYGUNLUK BEYANI (Üretim Kalite Güvencesi) 1) İmalatçı, imalat için
onaylanan kalite sistemini uygulayarak söz konusu tıbbi cihazların nihaî
kontrollerini bu Ekin (3) numaralı kısmında belirtildiği gibi yapar; ayrıca,
bu Ekin (4) numaralı kısmında belirtilen gözetim ve denetime tâbidir. 2) AT Uygunluk beyanı; bu Ekin
(1) numaralı kısmında belirtilen gerekleri yerine getiren imalatçının, söz
konusu ürünlerinin AT Tip-İnceleme Sertifikasında belirtilen tipe ve bu
Yönetmeliğin ilgili hükümlerine uygunluğunu garanti eden ve bildiren
işlemdir. İmalatçı, bu Yönetmeliğin 17 nci maddesine uygun olarak CE işaretini iliştirir
ve yazılı bir uygunluk beyanı hazırlar. Bu beyan ürün adı, ürün kodu
veya diğer ibarelerle açıkça tanımlanmış tüm tıbbi cihazları içerir ve
imalatçı tarafından muhafaza edilir. 3) Kalite sistemi: 3.1. İmalatçı, kalite
sisteminin değerlendirilmesi için onaylanmış kuruluşa başvurur. Bu başvuru şunları
içerir: - İmalatçının adı ve adresi, - İşleme esas tıbbi cihaz veya
tıbbi cihaz grubu ile ilgili bütün bilgiler, - Aynı tıbbi cihazlar hakkında
başka bir onaylanmış kuruluşa başvuru yapılmadığına dair yazılı beyan, - Kalite sistemi belgeleri, - Onaylanan kalite sisteminin
bütün gerekleri yerine getirme taahhüdü, - Onaylanan kalite sisteminin
eksiksiz ve etkili şekilde sürdürülmesi taahhüdü, - Gerektiğinde, onaylanan tipe
ilişkin teknik belge ve AT Tip-İnceleme Sertifikalarının bir örneği, - Üretim sonrası aşamada tıbbi
cihazlardan elde edilen verilerin, Ek Xdaki
hükümler de dâhil olmak üzere, gözden geçirilmesi ve gerekli düzeltici
faaliyetlerin uygulanması amacıyla bir sistem oluşturulması ve bu sistemin
güncel tutulmasına dair imalatçı taahhüdü. Bu taahhüt, imalatçının aşağıda
belirtilen durumlardan bilgisi olduğu andan itibaren Bakanlığı derhal
haberdar etme zorunluluğunu kapsar: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) (a) bendinde belirlenen
nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından piyasadan
sistematik olarak geri çekilmesine yol açan tıbbi cihazın özelliğine ve
performansına bağlı teknik ve tıbbi sebepler. 3.2. Kalite sisteminin
uygulanması, ürünlerin AT Tip-İnceleme Sertifikasında belirtilen tipe
uygunluğunu sağlamalıdır. Kalite sistemi için imalatçı
tarafından benimsenen bütün hükümler, gerekler ve öngörüler, sistematik ve
düzenli olarak yazılı politika ve işlemler şeklinde belgelendirilmelidir. Bu
kalite sistem belgelendirmesi, kalite planları, programları, el kitapları ve
kayıtlar gibi kalite politikası ve işlemlerinin aynı şekilde yorumlanmasına
imkân vermelidir. Bu belge, özellikle aşağıdaki
tanımları içerir: a) İmalatçının kalite
hedefleri, b) İşletmenin organizasyon
yapısı ve özellikle; - Tıbbi cihazın imalatı
konusunda yetkililerin ve çalışanların sorumlulukları, yetkileri ve kurumsal
yapılanma, - Uygun olmayan tıbbi
cihazların kontrolü dâhil, kalite sisteminin etkin işleyişini ve özellikle
istenen kalitede ürün gerçekleştirilmesini izlemek için kullanılan metotlar, - Tıbbi cihazın veya
parçalarının imalatı ve/veya nihai muayene ve testi üçüncü taraflarca
yapılıyor ise, kalite sisteminin etkin işleyişinin izlenmesine yönelik
yöntemler ve özellikle de üçüncü tarafa uygulanan kontrolün şekli ve
kapsamını; c) İmalat aşamasında denetim ve
kalite güvencesi teknikleri ve özellikle; - Sterilizasyon ve satın alma
konusunda uygulanacak işlemler, yöntemler ve ilgili belgeler, - İmalatın her aşamasındaki
çizimlerden, özelliklerden veya diğer ilgili belgelerden yararlanarak
hazırlanan ve güncel tutulan, tıbbi cihaz tanımlama işlemleri, ç) İmalat öncesinde, esnasında
ve sonrasında yapılacak uygun test ve denemeler, bunların hangi sıklıkla
yapılacağı, kullanılan test cihazları ve test cihazlarının kalibrasyonunun
geriye doğru izlenmesini mümkün kılacak hususları. 3.3. Onaylanmış kuruluş, kalite
sisteminin bu Ekin (3.2) numaralı kısmında belirtilen gereklere uygun olup
olmadığını saptamak için denetim yapar. İlgili uyumlaştırılmış standartların
uygulandığı kalite sistemlerinin, söz konusu gereklere uygun olduğu kabul
edilir. Değerlendirme ekibinde en az
bir üyenin, ilgili teknoloji hakkında değerlendirme deneyimi olmalıdır.
Değerlendirme işleminde imalat yöntemini kontrol etmek için imalatçı ve
gerektiğinde, imalatçının tedarikçisi de yerinde denetlenir. Karar, denetim
sonuçları ve açıklamalı değerlendirmeyle birlikte imalatçıya tebliğ edilir. 3.4. İmalatçı, kalite
sisteminin önemli değişikliklerine ilişkin bütün tasarılardan, kalite
sistemini onaylayan onaylanmış kuruluşa bilgi verir. Onaylanmış kuruluş, teklif
edilen değişiklikleri değerlendirir ve kalite sistemindeki bu değişikliklerin
bu Ekin (3.2) numaralı kısmında belirtilen gereklere uyup uymadığını inceler.
Söz konusu bilgilerin alınmasından sonra, denetim sonuçlarını ve açıklamalı
değerlendirmeyi içeren karar imalatçıya tebliğ edilir. 4) Gözetim ve denetim: 4.1. Gözetim ve denetimin
amacı, imalatçının, onaylanan kalite sisteminin gereklerini tam olarak yerine
getirmesini sağlamaktır. 4.2. İmalatçı, onaylanmış
kuruluşun gerekli tüm denetimleri gerçekleştirmesine izin verir ve kuruluşa
aşağıdaki bilgiler de dâhil olmak üzere gerekli bütün bilgileri temin eder; - Kalite sistemine ilişkin
belgeler, - Teknik belgeler, - Kalite sisteminin imalata
ilişkin bölümünde öngörülen muayene raporları, test verileri, kalibrasyon
verileri, ilgili personelin nitelikleri hakkındaki raporlar gibi veriler. 4.3. Onaylanmış kuruluş,
imalatçının onaylanan kalite sistemine uymasını sağlamak amacıyla periyodik
olarak denetim ve değerlendirme yapar, imalatçıya değerlendirme raporu verir. 4.4. Ayrıca, onaylanmış
kuruluş, imalatçıya habersiz ziyaretler yapabilir. Bu ziyaretlerde gerekli
görürse, kalite sisteminin iyi işlediğini denetlemek için test yapabilir veya
yaptırabilir. İmalatçıya bir denetim raporu ve eğer test yapılmışsa, test
raporu verilir. 5) İdarî hükümler: 5.1. İmalatçı veya yetkili
temsilcisi Bakanlığa ibraz etmek üzere, son tıbbi cihazın imalat tarihinden
itibaren en az 5 (beş) yıl ve vücuda yerleştirilebilir cihazlar için en az 15
(onbeş) yıl süreyle aşağıdaki belgeleri saklar: - Uygunluk beyanı, - Bu Ekin (3.1) numaralı
kısmında belirtilen kalite sistemi belgeleri, - Bu Ekin (3.4) numaralı
kısmında belirtilen değişiklikler, - Bu Ekin (3.1) numaralı
kısmında belirtilen AT Tip-inceleme sertifikasının bir örneği ve onaylanmış
tipe ilişkin teknik belgeler, - Bu Ekin (4.3) ve (4.4)
numaralı kısımlarında belirtilen onaylanmış kuruluşun karar ve raporları, - Gerektiğinde Ek IIIde belirtilen AT Tip-İnceleme Sertifikası. 6) Sınıf IIa
tıbbi cihazlar için uygulama: Bu Ek, aşağıda hususlar dikkate
alınarak, Yönetmeliğin 11 inci maddesindeki Sınıf IIa
tıbbi cihazlara uygulanabilir. 6.1. İmalatçı, bu Ekin (2),
(3.1) ve (3.2) numaralı kısımları hariç, Sınıf IIa
ürünlerini Ek VIInin (3) numaralı kısmında
belirtilen teknik belgelere uygun olarak imal ettiğini ve bu Yönetmeliğin
ilgili gereklerini karşıladığını, uygunluk beyanı ile garanti eder ve
açıklar. 6.2. Sınıf IIa
tıbbi cihazlar için, onaylanmış kuruluş, (3.3) numaralı kısımda yer alan
değerlendirmenin bir parçası olarak, bu Yönetmelik hükümlerine uygunluk
bakımından her bir cihaz alt-kategorisinden en az bir numune için Ek VIInin (3) numaralı kısmında yer alan teknik belgeleri
değerlendirir. 6.3. Onaylanmış kuruluş, numune
seçiminde, teknolojik yenilikleri, tasarımdaki benzerlikleri, teknolojiyi,
imalat ve sterilizasyon yöntemlerini, kullanım amacını ve bu Yönetmeliğe
uygun olarak geçmişte yapılmış değerlendirme sonuçlarını (ör. fiziksel,
kimyasal ve biyolojik özellikler bakımından) dikkate alır. Onaylanmış
kuruluş, alınan numunelere yönelik gerekçeyi Bakanlığa sunmak üzere hazır
bulundurur. 6.4. Onaylanmış kuruluş, (4.3)
numaralı kısımda yer alan gözetim ve denetim değerlendirmesi kapsamında başka
numuneleri de inceler. 7) İnsan kanı türevi ihtiva
eden tıbbi cihazlara yönelik uygulama: İnsan kanı türevi ihtiva eden
tıbbi cihazlardan her bir partinin/lotun imalatı tamamlandığında, imalatçı,
onaylanmış kuruluşu tıbbi cihaz partisinin/lotunun piyasaya arzı konusunda
bilgilendirir ve bunların piyasaya arzı ile ilgili olarak devlet laboratuvarı veya Bakanlıkça belirlenen başka bir laboratuvar tarafından Beşeri Tıbbi Ürünler
Ruhsatlandırma Yönetmeliği hükümlerine göre verilen resmî sertifikayı
onaylanmış kuruluşa gönderir. EK VI AT UYGUNLUK BEYANI (Ürün Kalite Güvencesi) 1) İmalatçı, üretim için
onaylanan kalite sistemini uygulayarak söz konusu tıbbi cihazların nihaî
muayene ve test işlemlerini, bu Ekin (3) numaralı kısmında belirtildiği gibi
yapar; ayrıca, bu Ekin (4) numaralı kısmında belirtilen gözetim ve denetime
tâbidir. Ek olarak imalatçı, piyasaya
steril halde arz edilen tıbbi cihazlarda, yalnızca sterilitenin
güvenceye alınması ve sürdürülmesi amaçlı imalat süreçleri için Ek Vin (3) ve (4) numaralı kısımlarının hükümlerini
uygular. 2) AT Uygunluk beyanı; bu Ekin
(1) numaralı kısmında belirtilen gerekleri yerine getiren imalatçının, söz
konusu ürünlerinin AT Tip-İnceleme Sertifikasında belirtilen tipe ve bu
Yönetmeliğin ilgili hükümlerine uygunluğunu garanti eden ve bildiren
işlemdir. İmalatçı, bu Yönetmeliğin 17 nci maddesine göre CE işaretini iliştirir ve yazılı bir
uygunluk beyanı hazırlar. Bu beyan ürün adı, ürün kodu veya diğer ibarelerle
açıkça tanımlanmış tüm tıbbi cihazları içerir ve imalatçı tarafından muhafaza
edilir. CE işareti, bu Ekte belirtilen işlemleri uygulayan onaylanmış
kuruluşun kimlik numarası ile birlikte yer alır. 3) Kalite sistemi: 3.1. İmalatçı, kalite
sisteminin değerlendirilmesi için onaylanmış kuruluşa başvurur. Başvuru aşağıdaki hususları
içerir: - İmalatçının adı ve adresi, - İşleme esas tıbbi cihaz veya
tıbbi cihaz grubu ile ilgili bütün bilgiler, - Aynı ürün için, başka bir
onaylanmış kuruluşa başvuruda bulunulmadığını belirten yazılı bir beyan, - Kalite sistemi hakkındaki
belgeler, - İmalatçının, onaylanan kalite
sisteminin gereklerini yerine getirme taahhüdü, - Onaylanan kalite sisteminin
tam ve etkili bir şekilde sürdürülmesine ilişkin imalatçı taahhüdü, - Gerektiğinde, onaylanan tipe
ait teknik belgenin ve AT Tip-İnceleme Sertifikasının bir örneği, - Üretim sonrası aşamada tıbbi
cihazlardan elde edilen verilerin, Ek Xdaki
hükümler de dâhil olmak üzere, gözden geçirilmesi ve gerekli düzeltici
faaliyetlerin uygulanması amacıyla bir sistem oluşturulması ve bu sistemin
güncel tutulmasına dair imalatçı taahhüdü. Bu taahhüt, imalatçının aşağıda
belirtilen durumlardan bilgisi olduğu andan itibaren Bakanlığı derhal
haberdar etme zorunluluğunu kapsar: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) (a) bendinde belirlenen
nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından piyasadan
sistematik olarak geri çekilmesine yol açan tıbbi cihazın özelliğine ve
performansına bağlı teknik ve tıbbi sebepler. 3.2. Kalite sistemi
çerçevesinde, her tıbbi cihaz veya partisinin/lotunun numunesi incelenir ve
tıbbi cihazın AT Tip-İnceleme Sertifikasında tanımlanan tip ile Yönetmeliğin
ilgili hükümlerine uygunluğunu sağlamak için bu Yönetmeliğin 7 nci maddesinde öngörülen ilgili standartlarda tanımlanan
uygun testler veya eşdeğer testler yapılır. İmalatçı tarafından benimsenen
bütün hükümler, gerekler ve öngörüler, sistematik ve düzenli olarak yazılı
önlemler, işlemler ve talimatlar şeklinde belgelendirilmelidir. Bu kalite
sistem belgelendirmesi, kalite planları, programları, el kitapları ve
kayıtlarının aynı şekilde yorumlanmasına imkân vermelidir. Bu belge, özellikle aşağıdaki
tanımları içerir: - Kalitenin hedefleri,
organizasyonun yapısı, tıbbi cihaz kalitesi konusunda organizasyonda çalışanların
sorumluluk ve yetkileri, - İmalattan sonra yapılan
incelemeler ve testler ile test ekipmanlarının kalibrasyonunun, geriye doğru
izlenmesini mümkün kılacak hususlar, - Kalite sisteminin etkin
olarak işlemesini izleme metotları, - Muayene, test ve kalibrasyon
ile ilgili raporlar ve ilgili personelin niteliği gibi kaliteye ait kayıtlar, - Tıbbi cihazın veya
parçalarının imalatı ve/veya nihai muayene ve testi üçüncü taraflarca
yapılıyor ise, kalite sisteminin etkin işleyişinin izlenmesine yönelik
yöntemler ve özellikle de üçüncü tarafa uygulanan kontrolün şekli ve kapsamı. Yukarıdaki incelemeler, sterilitenin güvence altına alınması amacıyla tasarlanan
imalat süreçlerine uygulanmaz. 3.3. Onaylanmış kuruluş, kalite
sisteminin bu Ekin (3.2) numaralı kısmında belirtilen gereklere uygun olup
olmadığını saptamak için denetimini yapar. İlgili uyumlaştırılmış
standartların uygulandığı kalite sistemlerinin, söz konusu gereklere uygun
olduğu kabul edilir. Değerlendirme ekibinde en az
bir üyenin, ilgili teknoloji hakkında değerlendirme deneyimi olmalıdır.
Değerlendirme işleminde imalat yöntemini kontrol etmek için imalatçı ve
gerektiğinde, imalatçının tedarikçisi de yerinde denetlenir. Karar, denetim
sonuçları ve açıklamalı değerlendirmeyle birlikte imalatçıya tebliğ edilir. 3.4. İmalatçı, kalite
sisteminin önemli değişikliklerine ilişkin bütün tasarılarından, kalite
sistemini onaylayan onaylanmış kuruluşa bilgi verir. Onaylanmış kuruluş, teklif
edilen değişiklikleri değerlendirir ve kalite sistemindeki bu değişikliklerin
bu Ekin (3.2) numaralı kısmında belirtilen gereklere uyup uymadığını inceler.
Söz konusu bilgilerin alınmasından sonra, denetim sonuçlarını ve açıklamalı
değerlendirmeyi içeren karar imalatçıya tebliğ edilir. 4) Gözetim ve denetim: 4.1. Gözetim ve denetimin
amacı, imalatçının onaylanan kalite sisteminin gereklerini tam olarak yerine
getirmesini garanti etmektir. 4.2. İmalatçı, onaylanmış
kuruluşu muayene, test ve depolama yerlerinin denetimi konusunda yetkili
kılar ve kuruluşa aşağıdaki bilgilerde dâhil olmak üzere gerekli bütün
bilgileri eksiksiz olarak temin eder; - Kalite sistemi belgeleri, - Teknik belgeler, - Muayene raporları, test ve
kalibrasyon verileri ile ilgili personelin nitelikleri gibi kaliteye ait
kayıtlar. 4.3. Onaylanmış kuruluş,
imalatçının kalite sistemini uyguladığını garanti etmek amacıyla, periyodik
olarak denetim ve değerlendirme yapar ve imalatçıya değerlendirme raporu
verir. 4.4. Onaylanmış kuruluş
imalatçıya habersiz ziyaretler yapabilir. Bu ziyaretlerde gerekli görürse,
kalite sisteminin iyi işlediğini ve ürünün bu Yönetmeliğin ilgili gereklerine
uygunluğunu denetlemek için test yapabilir veya yaptırabilir. Bu amaçla,
onaylanmış kuruluş nihai ürünün bir numunesini alır, inceler ve Yönetmeliğin
7 nci maddesinde öngörülen standartlarda tanımlanan
uygun testleri veya eşdeğer testleri uygular. Onaylanmış kuruluş, bir veya
birden fazla ürün numunesinin uygun olmadığı durumda gerekli tedbirleri alır. Onaylanmış kuruluş, imalatçıya
bir denetim raporu ve eğer test yapılmışsa, test raporu verir. 5) İdarî hükümler: 5.1. İmalatçı veya yetkili
temsilcisi Bakanlığa ibraz etmek üzere, son tıbbi cihazın imalat tarihinden
itibaren en az 5 (beş) yıl ve vücuda yerleştirilebilir cihazlar için en az 15
(onbeş) yıl süreyle aşağıdaki belgeleri saklar: - Uygunluk beyanı, - Bu Ekin (3.1) numaralı
kısmında belirtilen AT Tip-İnceleme Sertifikasının bir örneği ve onaylanmış
tip ile ilgili teknik belgeleri, - Bu Ekin (3.4) numaralı
kısmında belirtilen değişiklikleri, - Bu Ekin (3.4) numaralı
kısmının ikinci paragrafında ve yine bu Ekin (4.3) ile (4.4) numaralı
kısımlarında belirtilen onaylanmış kuruluş kararı ve raporları, - Gerektiğinde, Ek IIIde belirtilen uygunluk sertifikasını. 6) Sınıf IIa
tıbbi cihazlar için uygulama: Bu Ek, aşağıda hususlar dikkate
alınarak, Yönetmeliğin 11 inci maddesindeki Sınıf IIa
tıbbi cihazlara uygulanabilir. 6.1. İmalatçı, bu Ekin (2),
(3.1) ve (3.2) numaralı kısımları hariç, Sınıf IIa
ürünlerini EK VIInin (3) numaralı kısmında
belirtilen teknik belgelere uygun olarak imal ettiğini ve bu Yönetmeliğin
ilgili gereklerini karşıladığını, uygunluk beyanı ile garanti eder ve
açıklar. 6.2. Sınıf IIa
tıbbi cihazlar için, onaylanmış kuruluş, (3.3) numaralı kısımda yer alan
değerlendirmenin bir parçası olarak, bu Yönetmelik hükümlerine uygunluk
bakımından her bir cihaz alt-kategorisinden en az bir numune için Ek VIInin (3) numaralı kısmında yer alan teknik belgeleri
değerlendirir. 6.3. Onaylanmış kuruluş, numune
seçiminde, teknolojik yenilikleri, tasarımdaki benzerlikleri, teknolojiyi,
imalat ve sterilizasyon yöntemlerini, kullanım amacını ve bu Yönetmeliğe
uygun olarak geçmişte yapılmış değerlendirme sonuçlarını (ör. fiziksel,
kimyasal ve biyolojik özellikler bakımından) dikkate alır. Onaylanmış
kuruluş, alınan numunelere yönelik gerekçeyi Bakanlığa sunmak üzere hazır
bulundurur. 6.4. Onaylanmış kuruluş, (4.3)
numaralı kısımda yer alan gözetim ve denetim değerlendirmesi kapsamında başka
numuneleri de inceler. EK VII AT UYGUNLUK BEYANI 1) AT Uygunluk Beyanı; bu Ekin
(2) numaralı kısmında belirtilen yükümlülükleri ve ölçme fonksiyonu bulunan
tıbbi cihazlar ile steril olarak piyasaya arz edilen tıbbi cihazlar için bu
Ekin (5) numaralı kısmında belirtilen yükümlülükleri yerine getiren imalatçı
veya yetkili temsilcisinin, bu yükümlülükleri yerine getirdiğini ve söz
konusu cihazların bu Yönetmeliğin ilgili hükümlerine uygunluğunu beyan ve
garanti ettiği işlemdir. 2) İmalatçı bu Ekin (3) numaralı
kısmında açıklanan teknik belgeyi hazırlamalıdır. İmalatçı veya yetkili
temsilcisi uygunluk beyanını içeren bu teknik belgeyi en son tıbbi cihazın
imal edildiği tarihten itibaren en az 5 (beş) yıl süreyle yetkililerin
denetimi için saklar. Vücuda yerleştirilebilir cihazlar için söz konusu
saklama süresi son tıbbi cihazın imalatından itibaren en az 15 (onbeş) yıldır. 3) Bu teknik belge, tıbbi
cihazın Yönetmelik gereklerine uygunluğunun değerlendirilmesine imkân
sağlamalıdır. Bu belge aşağıdaki hususları içerir: - Yapılması planlanan her türlü
değişiklikler ve kullanım amaçlarını içeren ürünün genel bir tanımı, - Tasarım çizimleri, öngörülen
imalat metotları ile bileşenler, alt gruplar ve devreleri gösteren ayrıntılı
şema, - Tıbbi cihazın çalışması,
çizim ve şemaların anlaşılması için gerekli tanım ve açıklamalar, - Risk analizi sonuçları ve bu
Yönetmeliğin 7 nci maddesinde belirtilen
standartlardan tam veya kısmen uygulananların bir listesi ile bu standartlar
uygulanmadığında, bu Yönetmeliğin temel gereklerini karşılamak için
benimsenen çözümlerin tanımı, - Piyasaya steril olarak arz
edilen tıbbi cihazlar için kullanılan metotların tanımı ve validasyon raporu, - Uygulanan denetimler ile
tasarım hesaplamaları gibi sonuçları; tıbbi cihazın, amacına uygun olarak
çalışabilmesi için başka tıbbi cihaz(lar)a
bağlanması söz konusu ise, imalatçıları tarafından belirlenen özellikleri
taşıyan bu tıbbi cihaz(lar)ın
birbiriyle bağlandığı durumlarda temel gereklere uygun olduğunun kanıtı, - Ek Iin
(2) numaralı kısmına uygun olarak benimsenen çözümler, - Klinik öncesi değerlendirme, - Ek Xa
göre hazırlanmış klinik değerlendirme, - Etiket ve kullanım kılavuzu. 4) İmalatçı, tıbbi cihazın
yapısını ve risklerini dikkate alarak üretim sonrası aşamada tıbbi
cihazlardan elde edilen verilerin, Ek Xda yer alan
hükümler de dâhil olmak üzere, gözden geçirilmesi ve gerekli düzeltici
faaliyetlerin uygulanması amacıyla bir sistem oluşturulması ve bu sistemin
güncel tutulmasından sorumludur. Bu kapsamda imalatçının aşağıda belirtilen
durumlardan bilgisi olduğu andan itibaren Bakanlığı derhal haberdar etme
yükümlülüğü de bulunmaktadır: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) (a) bendinde belirlenen
nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından piyasadan
sistematik olarak geri çekilmesine yol açan tıbbi cihazın özelliğine ve
performansına bağlı teknik ve tıbbi sebepler. 5) İmalatçı, steril olarak
piyasaya arz edilen tıbbi cihazlar ile Sınıf Ide
yer alan ölçme fonksiyonlu tıbbi cihazlarla ilgili olarak, sadece bu Ekte
belirtilen şartlara değil, aynı zamanda Ek IIde,
Ek IVde, Ek Vde veya Ek
VIda belirtilen işlemlerden birine uygun hareket
etmelidir. Yukarıda belirtilen Eklerin
uygulanması ve onaylanmış kuruluşun müdahalesi; - Steril olarak piyasaya arz
edilen tıbbi cihazlarda, sadece steril şartların güvence altına alınması ve
sürdürülmesi ile ilgili imalat konuları, - Ölçüm fonksiyonlu tıbbi
cihazlarda, ürünlerin metrolojik gereklere
uygunluğuyla ilgili imalat konuları, ile sınırlıdır. Ayrıca bunlara,
bu Ekin (6) numaralı kısmının ikinci paragrafı uygulanır. 6) Sınıf IIa
tıbbi cihazlara yönelik uygulama: Bu Ek, aşağıdaki istisna
dikkate alınarak, Yönetmeliğin 11 inci maddesindeki Sınıf IIa
tıbbi cihazlara uygulanabilir. Bu Ek hükümleri; Ek IVde, Ek Vde veya Ek VIda belirtilen işlemlerle birlikte uygulandığında,
ilgili Eklerde belirtilen uygunluk beyanı tek bir beyan ile yapılır. Bu Eki
esas alan beyan ile ilgili olarak imalatçı, ürün tasarımının bu Yönetmeliğin
ilgili hükümlerini karşıladığını beyan ve garanti eder. EK VIII ÖZEL AMAÇLI CİHAZLARA İLİŞKİN BEYAN 1) İmalatçı veya yetkili
temsilcisi, ısmarlama üretilen cihazlar veya klinik araştırma amaçlı cihazlar
için bu Ekin (2) numaralı kısmında belirtilen bilgileri içeren bir beyan
hazırlar. 2) Bu beyan aşağıdaki bilgileri
kapsar: 2.1. Ismarlama üretilen
cihazlar için; - İmalatçının adı ve adresi, - Tıbbi cihazı tanımlayıcı
bilgiler, - Hastanın adıyla birlikte,
tıbbi cihazın belirli bir hasta tarafından kullanılacağını belirten beyan, - Reçeteyi yazan tabip ya da
diğer yetkili kişinin adı, gerektiğinde ilgili kliniğin adı, - Reçetede belirtilen tıbbi
cihazın spesifik özellikleri, - Söz konusu tıbbi cihazın Ek Ide belirtilen temel gereklere uygunluğunu ve bu
gerekleri tam olarak karşılamadığı durumlarda, bunları gerekçesiyle birlikte
açıklayan bir beyan. 2.2. Ek Xda
belirtilen klinik araştırma amaçlı cihazlar için; - Cihazı tanımlayıcı bilgiler, - Klinik araştırma planı, - Araştırmacı broşürü, - Araştırmaya konu olanların
sigorta kapsamında olduğuna dair teyit, - Bilgilendirilmiş gönüllü olur
formu, - Ek I/7.4de belirtilen bir
madde veya insan kanı türevinin bir bütünün parçası olarak cihazın yapısında
yer alıp almadığına ilişkin beyan, - Cihazın imalatında, hayvan
kaynaklı dokularla ilgili düzenlemelere uygun olarak hayvan kaynaklı
dokuların kullanılıp kullanılmadığına ilişkin beyan, - İlgili etik kurulun görüşleri
ve bu görüşlerle ilgili detaylı açıklamalar, - Araştırmadan sorumlu kurumun
ve tıbbi uygulayıcının veya diğer yetkili personelin adı, - Araştırmaların yapıldığı yer,
başlama tarihi ve planlanan süresi, - Cihazın, araştırmalar
kapsamındaki konular dışında kalan temel gereklere uygunluğu ile hastanın
güvenliği ve sağlığının korunması amacıyla alınan tüm tedbirleri belirten
beyan. 3) İmalatçı aynı zamanda
Bakanlığa gerektiğinde sunmak üzere: 3.1. Bu Yönetmeliğin gereklerini
taşıdığına ilişkin değerlendirme yapılmasına imkân verecek şekilde, ısmarlama
üretilen tıbbi cihazların tasarımına, imalatına, beklenen performansı ile
birlikte gerçek performansına ve imalat yer(ler)ine
ilişkin belgeyi hazır bulundurur. İmalatçı, imalat yönteminin, bu
kısmın birinci paragrafında belirtilen belgeye uygun tıbbi cihaz imal
etmesini sağlayacak şekilde gerekli bütün tedbirleri alır. 3.2. Klinik araştırma amaçlı
cihazlara ilişkin belgeler aşağıdaki bilgileri içermelidir: - Cihazın genel tanımı ve
kullanım amacı, - Tasarım çizimleri, özellikle
sterilizasyonla ilgili öngörülen imalat metotları ile bileşenler, alt gruplar
ve devreleri gösteren ayrıntılı şema, - Cihazın çalışması,
çizim ve şemaların anlaşılması için gerekli tanım ve açıklamalar, - Risk analizi sonuçları ve bu
Yönetmeliğin 7 nci maddesinde belirtilen
standartlardan tam veya kısmen uygulananların bir listesi ile bu standartlar
uygulanmadığında, bu Yönetmeliğin temel gereklerini karşılamak için
benimsenen çözümlerin tanımı, - Cihazın, Ek I/7.4de
bahsedilen, bir bütünün parçası olarak insan kanı türevi veya bir madde
ihtiva ettiği durumlarda, cihazın belirtilen amacını dikkate alarak, bu
çerçevede, insan kanı türevi veya maddenin kullanışlılığının, kalitesinin ve
güvenilirliğinin tayin edilmesi için gereken test sonuçlarına ait veriler, - Cihazın imalatında, hayvan
kaynaklı dokularla ilgili düzenlemelere uygun olarak hayvan kaynaklı
dokuların kullanıldığı durumlarda, enfeksiyon riskini azaltmak için uygulanan
risk yönetimine ilişkin önlemler, - Uygulanan denetim ve teknik
testler ile tasarım hesaplamaları gibi sonuçlar. İmalatçı, imalat sürecinde bu
kısmın birinci paragrafında belirtilen belgeye uygun cihaz imal edilmesini
sağlayacak gerekli bütün tedbirleri alır. İmalatçı bu tedbirlerin
etkililiğinin değerlendirilmesini veya gerektiğinde denetimini kabul ve
taahhüt eder. 4) Bu Ekte öngörülen bilgi ve
belgeler en az 5 (beş) yıl süreyle saklanır. Vücuda yerleştirilebilir
cihazlar için söz konusu saklama süresi en az 15 (onbeş)
yıldır. 5) Ismarlama üretilen tıbbi
cihazlar için imalatçı, üretim sonrası aşamada tıbbi cihazlardan elde edilen
verilerin, Ek Xda yer alan hükümler de dâhil olmak
üzere, gözden geçirilmesi ve gerekli düzeltici faaliyetlerin uygulanmasından
sorumludur. Bu kapsamda imalatçının aşağıda belirtilen durumlardan bilgisi
olduğu andan itibaren Bakanlığı derhal haberdar etme yükümlülüğü de
bulunmaktadır: a) Hastanın veya kullanıcının
sağlık durumunda ciddi bozulmaya ya da ölüme yol açabilecek veya yol açmış
olan; 1) Tıbbi cihazın özelliklerinin
ve/veya performansının bozulması ya da sapması, 2) Kullanım kılavuzu ve
etiketteki yetersizlikler, b) (a) bendinde belirlenen
nedenlerden dolayı aynı tip tıbbi cihazların imalatçısı tarafından piyasadan
sistematik olarak geri çekilmesine yol açan tıbbi cihazın özelliğine ve
performansına bağlı teknik ve tıbbi sebepler. EK IX SINIFLANDIRMA KURALLARI I. TANIMLAR: 1) Sınıflandırma kurallarında
yer alan tanımlar: 1.1. Süre esasına göre tıbbi
cihazlar: - Geçici süreli: Normalde 60 dakikadan az
bir sürede ve devamlı kullanılması amaçlanan tıbbi cihazlar. - Kısa süreli: Normalde 30
günden az ve sürekli kullanılması amaçlanan tıbbi cihazlar. - Uzun süreli: Normalde 30 günden fazla
ve sürekli kullanılması amaçlanan tıbbi cihazlar. 1.2. İnvaziv
cihazlar: Bu
cihazlar, vücut açıklığından veya vücut yüzeyini geçerek vücut içine kısmen
veya tamamen nüfuz eden, giren veya yerleştirilen tıbbi cihazlardır. - Vücut açıklığı: Göz yuvasının dış
yüzeyini de içeren vücuttaki herhangi bir doğal açıklık veya kalıcı olarak
açılmış (örneğin stoma) yapay açıklıktır. - Cerrahi invaziv
cihaz: Bu
tip cihazlar, bir cerrahi müdahale veya alet yardımı ile vücut yüzeyini
geçerek vücut içine yerleştirilen invaziv tıbbi
cihazlardır. Bu Yönetmeliğin amacına uygun
olarak tanımlanan ve yukarıda belirtilen tıbbi cihazlardan ayrı olarak,
vücudun mevcut girişleri haricindeki bir yere yerleştirilerek kullanılan
tıbbi cihazlar da cerrahi invaziv cihazlar olarak
tanımlanır. - İmplant
cihazlar: Cerrahi
müdahale ile bütünüyle insan vücuduna yerleştirilen ya da göz yüzeyi veya epitelyal yüzeyin yerine konan ve yerleştirme işleminden
sonra yerinde kalan tıbbi cihazlardır. İnsan vücuduna cerrahi
operasyonla kısmen yerleştirilen ve işlemden sonra en az 30 (otuz) gün
yerinde kalması öngörülen tıbbi cihazlar da implant
cihazlar olarak tanımlanır. 1.3. Tekrar kullanılabilir
cerrahi aletler: Hiçbir
aktif tıbbi cihaz ile bağlantısı olmaksızın, kesme, delme, kazıma, sıyırma,
birleştirme, çekme, tutturma veya benzeri cerrahi işlemleri yapmak için
kullanılan ve bu işlemler tamamlandıktan sonra tekrar kullanılabilen tıbbi
cihazlardır. 1.4. Aktif tıbbi cihazlar: Yer çekiminin ya da insan
vücudunun doğal olarak oluşturduğu enerji haricinde herhangi bir elektrik
enerjisi veya güç kaynağıyla ve bu enerjinin dönüşümüyle çalışan tıbbi
cihazlardır. Tıbbi cihaz ile hasta arasında enerjinin, maddelerin ve diğer
elementlerin, önemli bir değişime uğramadan, geçişini sağlayan cihazlar,
aktif tıbbi cihaz sayılmaz. Tek başına tıbbi cihaz olan yazılımlar aktif
tıbbi cihaz sayılır. 1.5. Aktif tedavi edici
cihazlar: Bir
hastalığın, yaralanmanın veya sakatlığın tedavi edilmesi veya hafifletilmesi
için tek başına veya diğer tıbbi cihazlarla birlikte, biyolojik yapıları veya
fonksiyonları destekleyen, değiştiren, yerine koyan veya yenileyen tıbbi
cihazlardır. 1.6. Teşhis amaçlı aktif
cihazlar: Fizyolojik
şartları, sağlık durumunu, hastalıkları veya kalıtımsal bozuklukları tespit
etmek, tanı koymak, izlemek veya tedavi etmek için bilgi sağlayan tek başına
veya başka tıbbi cihazlarla birlikte kullanılan aktif tıbbi cihazlardır. 1.7. Merkezî dolaşım sistemi: Bu Yönetmelik amacı
çerçevesinde merkezî dolaşım sistemi aşağıdaki damarları içerir: Arteriaepulmonalis, aorta ascendens,
arcus aorta, bifurcatioaortaya
kadar aorta descendens, arteriaecoronariae,
arteriacarotiscommunis, arteriacarotisexterna,
arteriacarotisinterna, arteriaecerebralis,
truncusbrachicephalicus, venaecordis,
venaepulmonalis, vena cava superior
ve vena cava inferior. 1.8. Merkezî sinir sistemi: Bu Yönetmelik amacı
çerçevesinde merkezî sinir sistemi beyin, beyin-omurilik zarları ve omuriliği
içerir. II. UYGULAMA KURALLARI: 2) Uygulama kuralları: 2.1. Sınıflandırma kurallarının
uygulanması, tıbbi cihazların öngörülen amaçlarına göre belirlenir. 2.2. Eğer tıbbi cihaz diğer bir
tıbbi cihaz ile beraber kullanılacak ise, sınıflandırma kuralı her tıbbi
cihaza ayrı ayrı uygulanır. Aksesuarlar ise,
beraber kullanıldıkları tıbbi cihazlardan ayrı olarak sınıflandırılır. 2.3. Tıbbi cihazın kullanımını
etkileyen veya tıbbi cihazı çalıştıran yazılım da aynı sınıfa girer. 2.4. Tıbbi cihaz, vücudun
sadece belirli bir bölümünde kullanılmayacak ise, belirlenen en kritik
kullanım yeri esas alınarak sınıflandırılır. 2.5. İmalatçısı tarafından
belirlenen performansına bağlı olarak aynı tıbbi cihaza birden fazla kural
uygulanabiliyor ise, tıbbi cihaz bunlardan en yüksek sınıflandırma
kapsamındaki en katı kural çerçevesinde değerlendirilir. 2.6. Birinci bölümün (1.1)
numaralı kısmında yer alan sürenin hesaplanması ile ilgili olarak, sürekli
kullanım, tıbbi cihazın kullanım amacı doğrultusunda kesintisiz olarak
fiilen kullanılması anlamına gelir. Bununla birlikte tıbbi cihazın, aynı
veya benzer bir tıbbi cihazla derhal değiştirilmek üzere kullanımının kesilmesi,
söz konusu tıbbi cihazın sürekli kullanımı kapsamında değerlendirilir. III. SINIFLANDIRMA: 1) İnvaziv
olmayan cihazlar: 1.1. Kural 1: Bütün invaziv
olmayan cihazlar, aşağıdaki kurallardan birine girmedikçe Sınıf I içinde yer
alır. 1.2. Kural 2: Kanın, vücut sıvılarının veya
dokularının alınıp verilmesi veya saklanması, sıvı veya gazların vücuda infüzyonu, verilmesi veya uygulanması amacına yönelik
bütün invaziv olmayan cihazlar; - Sınıf IIadaki
veya daha yüksek sınıftaki aktif tıbbi cihazlara bağlanabiliyor ise, - Kanın veya diğer vücut
sıvılarının alınıp verilmesi veya saklanması veya organların, organ parçalarının
veya vücut dokularının saklanması amacına yönelik ise, Sınıf IIada yer alır. Diğer bütün durumlarda Sınıf Ie girer. 1.3. Kural 3: Kanın, diğer vücut sıvılarının
veya vücuda infüzyonu amaçlanan diğer sıvıların
kimyasal veya biyolojik bileşimlerini değiştiren tüm invaziv
olmayan cihazlar Sınıf IIbye girer. Ancak tedavi;
gazın veya ısının filtrasyonu, santrifüjü veya
değişimini içeriyor ise, bu durumda Sınıf IIaya
girer. 1.4. Kural 4: Yaralı ciltle temas eden tüm invaziv olmayan cihazlar; - Salgıların emilimi veya
baskılanması için mekanik bariyer olarak kullanılıyorsa Sınıf Ie girer. - Esas olarak dermis tabakasının tahribatı sonucu oluşan yaralarda
kullanılması öngörülen ve ikincil amaç olarak sadece iyileşmeyi sağlayan
tıbbi cihazlar Sınıf IIbye girer. - Esas olarak yaranın mikro
çevresini iyileştirme amaçlı tıbbi cihazlar dâhil, diğer bütün durumlarda
kullanılan tıbbi cihazlar Sınıf IIaya girer. 2) İnvaziv
cihazlar: 2.1. Kural 5: Cerrahi invaziv
cihazlar haricinde, yalnız Sınıf I aktif tıbbi cihaza bağlanan vücut açıklığı
ile ilgili tüm invaziv cihazlar: - Geçici kullanımı öngörülenler
Sınıf Ie girer. - Kısa süreli kullanım amaçlı
tıbbi cihazlar Sınıf IIaya girer. Ancak, yutağa
kadar olan ağız boşluğu içinde, kulak zarına kadar olan kulak kanalı veya
nazal boşlukta kullanılanlar Sınıf Ie girer. - Uzun süreli kullanım amaçlı
tıbbi cihazlar Sınıf IIbye girer. Ancak, mukoz zarlardan emilmeye uygun olmayan ve yutağa kadar
olan ağız boşluğu içinde, kulak zarına kadar olan kulak kanalı veya nazal
boşlukta kullanılanlar Sınıf IIaya girer. Cerrahi invaziv
cihazlar haricinde, Sınıf IIa veya daha üst bir
sınıfa giren bir aktif tıbbi cihaz ile bağlantılı olarak kullanımı öngörülen,
vücut açıklığı ile ilgili bütün invaziv cihazlar
Sınıf IIaya girer. 2.2. Kural 6: Bütün geçici kullanımlı cerrahi
invaziv cihazlar Sınıf IIaya
girer. Ancak: - Özellikle kalpte veya merkezî
dolaşım sistemindeki bir bozukluğu vücudun bu bölümlerine doğrudan temas ederek
kontrol eden, teşhis eden, izleyen veya düzelten cerrahi invaziv
cihazlar Sınıf IIIe girer. - Tekrar kullanılabilir cerrahi
aletler Sınıf Ie girer. - Özellikle merkezi sinir
sistemine doğrudan temas ederek kullanılan cerrahi invaziv
cihazlar, Sınıf IIIe girer. - İyonlaştırıcı radyasyon
formunda enerji sağlamayı amaçlayan cerrahi invaziv
cihazlar Sınıf IIbye girer. - Biyolojik etkiye sahip veya
tamamı ya da büyük bir çoğunluğu absorbe edilen
cerrahi invaziv cihazlar Sınıf IIbye
girer. - İlaçları vücuda vermek
amacıyla kullanılan cerrahi invaziv cihazlar,
kullanım şekli bakımından potansiyel bir tehlike oluşturuyor ise, bu durumda
Sınıf IIbye girer. 2.3. Kural 7: Aşağıdaki durumlar dışında kısa
süreli kullanım için olan bütün cerrahi invaziv
cihazlar Sınıf IIaya girer: - Kalpteki veya merkezî dolaşım
sistemindeki bir bozukluğu vücudun bu kısımlarına doğrudan temas ederek kontrol
eden, teşhis eden, izleyen veya düzelten tıbbi cihazlar Sınıf IIIe girer. - Özellikle merkezi sinir
sistemine doğrudan temas ederek kullanılan cerrahi invaziv
cihazlar, Sınıf IIIe girer. - İyonlaştırıcı radyasyon
formunda enerji sağlayan tıbbi cihazlar Sınıf IIbye
girer. - Biyolojik etkiye sahip veya
tamamı ya da büyük bir çoğunluğu absorbe edilen
cerrahi invaziv cihazlar Sınıf IIIe
girer. - Diş içine yerleştirilenler
hariç, vücutta kimyasal değişime uğrayan veya ilaç vermede kullanılan tıbbi
cihazlar Sınıf IIbye girer. 2.4. Kural 8: Aşağıdaki durumlar dışında,
bütün implant cihazlar ve uzun süreli cerrahi invaziv cihazlar Sınıf IIbye
girer. - Dişlere yerleştirilen tıbbi
cihazlar Sınıf IIaya girer. - Kalp, merkezî dolaşım sistemi
veya merkezî sinir sistemiyle doğrudan temas edecek şekilde kullanılan tıbbi
cihazlar Sınıf IIIe girer. - Biyolojik etkiye sahip veya
tamamı ya da büyük bir çoğunluğu absorbe edilen
tıbbi cihazlar Sınıf IIIe girer. - Diş içine yerleştirilenler
hariç, vücutta kimyasal değişime uğrayan veya ilaç vermede kullanılan tıbbi
cihazlar Sınıf IIIe girer. - Meme implantları
Sınıf IIIe girer. - Omuz, diz ve kalça eklem
değişimi cihazları, Sınıf IIIe girer. 3) Aktif cihazlara uygulanan ek
kurallar: 3.1. Kural 9: Enerji verme veya enerji
dönüşümünü sağlamaya yönelik tüm aktif tedavi edici cihazlar Sınıf IIaya girer. Ancak yapısı, yoğunluğu ve enerji uygulama
yeri dikkate alındığında, insan vücudundan enerji alıp vermede veya enerji
dönüşümünü sağlamada potansiyel bir risk oluşturuyor ise Sınıf IIbye girer. Sınıf IIbde
yer alan aktif tedavi edici cihazların performanslarını izleyen veya kontrol
eden tıbbi cihazlar veya bu cihazların performanslarını doğrudan etkileyen
tüm aktif cihazlar da Sınıf IIbye girer. 3.2. Kural 10: Teşhis amaçlı aktif cihazlar
Sınıf IIaya girer; - Gözle görülebilir bir
spektrumda, hasta vücudunu aydınlatmak için kullanılan tıbbi cihazlar hariç,
insan vücudu tarafından absorbe edilecek enerjiyi
sağlayan tıbbi cihazlar, - Radyofarmasötiklerin
in vivo (vücut içi) dağılımını görüntülemede
kullanılan tıbbi cihazlar, - Hayati fizyolojik
fonksiyonların doğrudan teşhisi veya izlenmesine olanak sağlayan tıbbi
cihazlar. Ancak, merkezî sinir sistemi
faaliyetleri, solunum ve kalp fonksiyonlarındaki değişiklikler gibi hastanın
durumunda ani tehlike yaratacak yapıdaki değişiklikleri izlemeye yönelik olan
tıbbi cihazlar Sınıf IIbye girer. İyonlaştırıcı radyasyon yayan
ve girişimsel radyolojik teşhis ve tedavi amaçlı cihazlar ile bu aktif
cihazları kontrol ve izlemeye yönelik veya bunların performansını doğrudan
etkileyen bütün aktif cihazlar Sınıf IIbye girer. 3.3. Kural 11: İlaçları, vücut sıvılarını veya
diğer maddeleri vücuda veren ve/veya alan tüm aktif cihazlar Sınıf IIaya girer. Ancak veriliş şekli, vücudun ilgili bölümü
ve verilen maddelerin özelliği dikkate alındığında, bu işlem potansiyel bir
risk oluşturuyor ise Sınıf IIbye girer. 3.4. Kural 12: Diğer bütün aktif cihazlar
Sınıf Ie girer. 4) Özel kurallar: 4.1. Kural 13: Ayrı olarak kullanıldığında
Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliğine göre tıbbi ürün olarak
değerlendirilen ve tıbbi cihazın insan üzerindeki etkisini destekleyen bir
maddeyi, ihtiva eden bütün tıbbi cihazlar, Sınıf IIIe
girer. İnsan kanı türevi ihtiva eden
tüm tıbbi cihazlar, Sınıf IIIe girer. 4.2. Kural 14: Doğum kontrolü veya cinsel
temasla geçen hastalıkların bulaşmasını engellemek amacıyla kullanılan bütün
tıbbi cihazlar Sınıf IIbye girer. Ancak, implant veya uzun süreli invaziv
cihaz olması halinde, Sınıf IIIe girer. 4.3. Kural 15: Kontakt lensleri dezenfekte etmeye,
temizlemeye, durulamaya ve gerektiğinde nemlendirmeye yarayan tıbbi cihazlar
Sınıf IIbye girer. Özellikle tıbbi cihazları
dezenfekte etmeye yarayan tıbbi cihazlar Sınıf IIaya
girer. İnvaziv cihazları dezenfekte etmeye yarayan
tıbbi cihazlar, Sınıf IIbye girer. Bu kural kontakt
lensler dışındaki tıbbi cihazları fiziksel etkiyle temizleyen diğer ürünlere
uygulanmaz. 4.4. Kural 16: Özellikle X-ray teşhis
görüntülerini kaydetme amacıyla kullanılan tıbbi cihazlar Sınıf IIaya girer. 4.5. Kural 17: Sadece sağlam deri ile teması
amaçlanan tıbbi cihazlar hariç, hayvan dokuları veya ölü doku parçaları
kullanılarak imal edilen bütün tıbbi cihazlar Sınıf IIIe
girer. 5) Kural 18: Diğer kurallardan farklı olarak
kan torbaları, Sınıf IIbye girer. EK X KLİNİK DEĞERLENDİRME 1) Genel hükümler: 1.1. Genel bir kural olarak, tıbbi
cihazın normal kullanım koşulları altında, Ek Iin
(1) ve (3) numaralı kısımlarında belirtilen performans ve özellikler
bakımından gerekleri karşıladığına ilişkin teyit ve Ek Iin
(6) numaralı kısmında belirtilen fayda-risk oranının kabul edilebilirliğine
ve yan etkilere ilişkin değerlendirme, klinik verilere dayanmalıdır. Bu
verilere ilişkin değerlendirme, bundan böyle klinik değerlendirme olarak
anılacak olup gerektiğinde ilgili uyumlaştırılmış standartlar dikkate alınmak
suretiyle, metodolojik olarak kabul edilebilir ve tanımlanmış olan ve
aşağıdaki hususlardan birine dayanan bir prosedürü izlemelidir. 1.1.1. Söz konusu prosedür; - Kendisi ile ilgili veri
bulunan tıbbi cihaz ile değerlendirmeye tabi tutulan tıbbi cihazın eşdeğer
olması ve - Söz konusu verilerin, ilgili
temel gereklerle tam bir uyum göstermesi halinde, tıbbi cihazın güvenliğine,
performansına, tasarım özelliklerine ve kullanım amacına ilişkin olarak
mevcut ilgili bilimsel literatürün kritik değerlendirilmesine dayanabilir. 1.1.2. Söz konusu prosedür,
yapılan tüm klinik araştırmalardan elde edilen sonuçların kritik
değerlendirmesine dayanabilir. 1.1.3. Söz konusu prosedür,
(1.1.1) ve (1.1.2) numaralı kısımlarda belirtilen klinik verilerin
birleştirilmesi ile yapılacak kritik değerlendirmeye dayanabilir. 1.1a Vücuda yerleştirilebilir
cihazlar ve Sınıf III tıbbi cihazların mevcut klinik verilere dayandığı tam
olarak gerekçelendirilemez ise bu cihazlar için klinik araştırma yapılır. 1.1b Klinik değerlendirme ve
elde edilen sonuçlar belgelendirilir. Söz konusu belgelere ve/veya bunları
tam olarak tanımlayan bilgilere, tıbbi cihazın teknik dosyasında yer verilir. 1.1c Klinik değerlendirme ve
buna ilişkin belgeler, piyasaya arz sonrası gözetim ve denetimden elde edilen
veriler doğrultusunda sürekli olarak güncellenmelidir. Tıbbi cihazın piyasaya
arz sonrası gözetim ve denetim planı kapsamında, piyasaya arz sonrası klinik
takibin gerekli görülmediği hallerde, bu durum tam olarak gerekçelendirilir
ve belgelendirilir. 1.1d Klinik verilere dayalı
olarak temel gereklere uygunluğun gösterilmesinin uygun olmadığı durumlarda,
tıbbi cihaz ile vücudun etkileşim özellikleri, amaçlanan klinik performans ve
imalatçının savları dikkate alınarak ve risk yönetimi çıktılarına dayanılarak
uygun bir gerekçelendirme yapılır. Sadece performans değerlendirmesine, kıyas
testine ve klinik öncesi değerlendirmeye dayanılarak tıbbi cihazın temel
gereklere uygunluğu gösterilecek ise bu durumun tam olarak gerekçelendirilmesi
gerekir. 1.2. Bu Yönetmeliğin 20 nci maddesi gereğince, bütün veriler gizli kalmalıdır. 2) Klinik araştırmalar: 2.1. Klinik araştırmanın amacı; - Tıbbi cihazın normal kullanım
koşullarındaki performansının Ek Iin (3) numaralı
kısmına göre uygunluğunun değerlendirilmesi, - Normal kullanım koşullarındaki
istenmeyen herhangi bir yan etkiyi ve bu etkinin tıbbi cihazın amaçlanan
performansıyla kıyaslandığında kabul edilebilir bir risk oluşturup
oluşturmadığının değerlendirilmesidir. 2.2. Etik Değerlendirmeler; Klinik araştırmalar, 1964de Finlandiyanın Helsinki şehrinde yapılan 18 inci Dünya Tıp
Asamblesinde kabul edilen ve son düzenlemeleri Dünya Tıp Asamblesinde
yapılan, Helsinki Bildirgesine göre gerçekleştirilmelidir. İnsan sağlığını
korumaya yönelik bütün tedbirlerin Helsinki Bildirgesi çerçevesinde uygulanması
zorunludur. Bu Bildirge, ihtiyacın fark edildiği ve çalışmanın
gerekçelendirildiği andan sonuçların yayınlanmasına kadar, klinik
araştırmanın her aşamasını içerir. 2.3. Metotlar; 2.3.1. Klinik araştırmalar,
güncelliğini koruyan bilimsel ve teknik bilgileri yansıtan bir plana göre
uygulanmalı ve imalatçının tıbbi cihaza ilişkin iddialarını doğrulayıcı veya
reddedici şekilde belirlenmelidir. Bu araştırmalar, sonuçların bilimsel
geçerliliğini garantileyen yeterli sayıda gözlem içermelidir. 2.3.2. Araştırmaları
gerçekleştirmek için kullanılan metotlar incelenen tıbbi cihaza uygun
olmalıdır. 2.3.3. Klinik araştırmalar
tıbbi cihazın normal koşullarda kullanımına benzer şartlarda yapılmalıdır. 2.3.4. Tıbbi cihazın
performansı ve güvenilirliği ile ilgili olanlar da dâhil, uygun bütün
özellikleri ve bunların hasta üzerindeki etkileri incelenmelidir. 2.3.5. Bütün ciddi olumsuz
durumlar, eksiksiz olarak kaydedilmeli ve klinik araştırmanın yapıldığı
ülkeye/ülkelere ve bu ülkenin/ülkelerin adıyla birlikte Bakanlığa derhal
bildirilmelidir. 2.3.6. Araştırmalar, ilgili
tıbbi uygulayıcı veya konusunda uzman yetkili kişi tarafından uygun bir
ortamda yapılmalıdır. İlgili tıbbi uygulayıcı veya
konusunda uzman yetkili kişi tıbbi cihaza ilişkin teknik ve klinik verilere sahip
olmalıdır. 2.3.7. Yazılan rapor, klinik
araştırma süresince toplanan bütün verilerin eleştirel bir değerlendirilmesini
içermeli ve sorumlu ilgili tıbbi uygulayıcı veya diğer yetkili kişi
tarafından imzalanmalıdır. EK XI ONAYLANMIŞ KURULUŞUN ATANMASINA İLİŞKİN ASGARÎ
ÖZELLİKLER 1) Onaylanmış kuruluşun
yöneticisi ile değerlendirme ve doğrulama işlemini yürüten personeli, aynı
zamanda denetimlerini yaptıkları tıbbi cihazları tasarlayan, imal eden, temin
eden, kullanan veya kurulumunu yapan kişiler ya da bu kişilerin yetkili
temsilcileri olamazlar. Bu kişiler tıbbi cihazların tasarımına, yapımına,
pazarlanmasına veya bakımına doğrudan katılmamalı veya bu faaliyetlerde görev
alan tarafları temsil etmemelidir. Bu hususlar imalatçı ile kurum arasındaki
teknik bilgi alışverişini engellemez. 2) Onaylanmış kuruluş ve ilgili
personeli, tıbbi cihazlar alanında yeterli bilgiye sahip olmalı,
değerlendirme ve doğrulama işlemlerini meslekî etik kurallar içinde
gerçekleştirmelidir. Özellikle doğrulama sonuçlarından çıkar sağlayacak kişi
ve gruplardan gelen denetim sonuçlarını etkileyebilecek tüm baskılarından ve
parasal yönlendirmelerden uzak olmalıdırlar. Onaylanmış kuruluşlar
görevlendirildikleri uygunluk değerlendirme faaliyetlerinin bir kısmını,
sözleşme yaparak özellikle bu Ekin ve Yönetmeliğin hükümlerini karşılayan bir
yüklenici/taşeron kuruluşa yaptırabilirler. Onaylanmış kuruluş,
yüklenicinin/taşeronun niteliklerini değerlendiren ve yaptığı işlerle ilgili
bütün belgeleri gerektiğinde Bakanlığa sunmak üzere saklar. 3) Onaylanmış kuruluş Ek II,
III, IV, V ve VI arasındaki eklerden birine göre kendisine verilen görevi
yapmaya veya kendi sorumluluğu altında yaptırmaya yetkin olmalıdır. Onaylanmış kuruluş,
değerlendirme ve doğrulama faaliyetlerinin gerektirdiği teknik ve idarî
işlemleri yürütmesi için gerekli personel ve teknik imkânlara sahip
olmalıdır. Ayrıca, bu Yönetmelik gereklerini, özellikle Ek Ide düzenlenen şartları göz önünde bulundurarak,
bildirdiği tıbbi cihazın tıbbi işlerliği ve performansını değerlendirebilecek
deneyime ve bilgiye sahip yeterli sayıda uzman personel istihdam etmelidir.
Doğrulamalar için gerekli olan ekipmanlar ulaşılabilir olmalıdır. 4) Onaylanmış kuruluşun ilgili
personeli: - Atandığı değerlendirme ve
doğrulama işlemlerinin tamamını kapsayan meslekî eğitime, - Yaptığı denetim kuralları
hakkında yeterli bilgiye ve denetim tecrübesine, - Yapmış olduğu denetimleri
gösteren sertifikaları, kayıtları ve raporları düzenleme becerisine, sahip olmalıdır. 5) Onaylanmış kuruluş,
tarafsızlığını garanti etmelidir. Ücretler, yapılan denetimlerin sayısına
veya sonuçlarına bağlı olmamalıdır. 6) Onaylanmış
kuruluş, kendisine verilen yetkilere istinaden yaptığı her türlü işlem ile
ilgili olarak hukukî sorumluluğu üstlenmelidir. 7) Bu Yönetmelik hükümlerine
göre, onaylanmış kuruluşun personeli, görevi sebebiyle öğrendiği her türlü bilgileri yetkili idarî ve adlî mercilerin
talepleri olması hali dışında, meslekî sır olarak saklamalıdır. EK
XII CE
UYGUNLUK İŞARETİ CE
uygunluk işareti "CE" harflerinden oluşur.
- Eğer işaret büyültülür
veya küçültülür ise, yukarıdaki çizim içinde gösterilen oranlar
değişmemelidir. - CE işareti harfleri,
aynı tarz ve dikey boyutlarda olmalıdır. Dikey boyut, 5 (beş) milimetreden
küçük olamaz. Bu minimal boyut, küçük boyutlu tıbbi cihazlar için zorunlu
değildir. 7 Haziran 2011
SALI Resmî Gazete Sayı : 27957 |